
| 1 |
| 2 |
| 6.72 |
| 22.4 |
| 1.2mol |
| 0.1L |


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
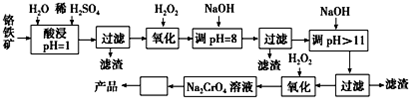
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铵溶液显酸性:NH4++H2O?NH3?H2O+H+ |
| B、向AgCl悬浊液中加Na2S溶液,白色沉淀变成黑色:2Ag++S2-=Ag2S↓ |
| C、将足量CO2通入Na2SiO3溶液中,出现白色沉淀:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
| D、向Na[Al(OH)4]溶液中加入NaHCO3溶液,出现白色沉淀:[Al(OH)4]++HCO3-═Al(OH)3↓+H2O+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳原子由基态变为激发态 |
| B、碳原子由激发态变为基态 |
| C、该过程将产生发射光谱 |
| D、碳原子要向外界环境释放能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 经过反应也可制得化合物Ⅳ,则R在NaOH醇溶液中反应的化学方程式为:
经过反应也可制得化合物Ⅳ,则R在NaOH醇溶液中反应的化学方程式为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com