
| Ksp |
| c(Cl-) |
| Ksp |
| c(Cl-) |
| 1.8×10-10 |
| 0.2 |


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
| A、含氧酸能起氧化作用,无氧酸则不能 |
| B、阳离子只有氧化性,阴离子只有还原性 |
| C、失电子难的原子获得电子的能力一定强 |
| D、由X变为X2+的反应是氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢铵 | B、硝酸铵 |
| C、氯化铵 | D、磷酸氢二铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.依据溴乙烷的性质,请你进行以下探究.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.依据溴乙烷的性质,请你进行以下探究.| 图序 | 装置图 | 所盛试剂 | 实验现象 |
| 1 |  | A是 | |
| 2 |  | C是 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | a极板 | b极板 | X电极 | Z溶液 | 装置图 |
| A | 锌 | 石墨 | 负极 | CuSO4溶液 | 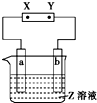 |
| B | 石墨 | 石墨 | 负极 | NaOH溶液 | |
| C | 银 | 铁 | 正极 | AgNO3溶液 | |
| D | 铜 | 石墨 | 负极 | CuCl2溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 高炉炼铁中发生的基本反应之一如下:FeO(固)+CO(气)?Fe(固)+CO2(气)(△H>0).
高炉炼铁中发生的基本反应之一如下:FeO(固)+CO(气)?Fe(固)+CO2(气)(△H>0).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

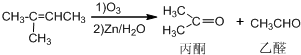
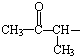 、且属于酯类的同分异构体:
、且属于酯类的同分异构体:
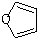 )也可以发生“Diels-Alder反应”,该化学反应方程式为:
)也可以发生“Diels-Alder反应”,该化学反应方程式为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com