
| 选项 | a极板 | b极板 | X电极 | Z溶液 | 装置图 |
| A | 锌 | 石墨 | 负极 | CuSO4溶液 | 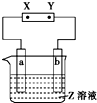 |
| B | 石墨 | 石墨 | 负极 | NaOH溶液 | |
| C | 银 | 铁 | 正极 | AgNO3溶液 | |
| D | 铜 | 石墨 | 负极 | CuCl2溶液 |
| A、A | B、B | C、C | D、D |


 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
| A、HF | B、HCl |
| C、HBr | D、HI |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
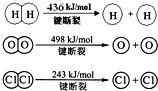
查看答案和解析>>
科目:高中化学 来源: 题型:
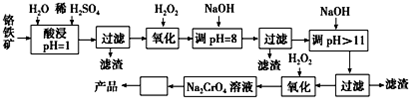
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中所有离子浓度均减小 | ||
| B、pH的变化值等于2 | ||
C、溶液中
| ||
| D、分别与足量的Mg粉反应,0.01 mol/L的醋酸溶液产生的氢气较少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com