
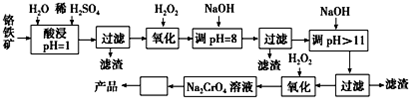
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8 | 9(>9溶解) |


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.依据溴乙烷的性质,请你进行以下探究.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.依据溴乙烷的性质,请你进行以下探究.| 图序 | 装置图 | 所盛试剂 | 实验现象 |
| 1 |  | A是 | |
| 2 |  | C是 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | a极板 | b极板 | X电极 | Z溶液 | 装置图 |
| A | 锌 | 石墨 | 负极 | CuSO4溶液 | 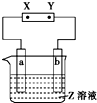 |
| B | 石墨 | 石墨 | 负极 | NaOH溶液 | |
| C | 银 | 铁 | 正极 | AgNO3溶液 | |
| D | 铜 | 石墨 | 负极 | CuCl2溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 高炉炼铁中发生的基本反应之一如下:FeO(固)+CO(气)?Fe(固)+CO2(气)(△H>0).
高炉炼铁中发生的基本反应之一如下:FeO(固)+CO(气)?Fe(固)+CO2(气)(△H>0).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入少量冰醋酸,溶液的pH减小,CH3COOH的电离度增大 | ||
| B、滴加少量0.1mol/LHCl溶液,溶液中C(H+)减少 | ||
| C、加入少量Na2CO3固体,平衡不移动 | ||
D、加水稀释,可使溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤⑥ |
| B、①③④⑥⑧ |
| C、①②④⑥⑦ |
| D、③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com