
【题目】化工中把电解饱和食盐水的工业生产叫氯碱工业,其生产流程如下:

除去食盐水中的Ca2+、Mg2+、SO42—,应分别加入下列沉淀剂:①NaOH(aq)、
②Na2CO3(aq)、③BaCl2(aq),加入沉淀剂的顺序为 (填序号);加入盐酸的作用为 。
(2)下图为实验室电解饱和食盐水的实验装置。X、Y均为石墨电极,两极周围溶液均滴有几滴酚酞试液。

①电解一段时间后,X电极及附近溶液能观察到的现象是 ;
Y电极上的电极反应式为 ,检验该极产生的气体的方法是 。
②电解饱和食盐水的离子方程式为 ;若饱和食盐水体积为200mL,且忽略电解过程中的体积变化及气体溶解,当两极共收集到气体(共两种)44.8mL(标准状况)时,溶液的pH= 。
【答案】(1)①③②或③①②或③②① 除去过量的OH—和CO32—(或NaOH和Na2CO3)
(2)① X电极上有气泡产生,附近溶液逐渐变红色(各1分) 2Cl——2e—=Cl2↑
用湿润的淀粉KI试纸检验,若试纸变蓝,证明该极产生Cl2(合理答案均给分)
②2Cl-+2H2O![]() H2↑+Cl2↑+2OH-12
H2↑+Cl2↑+2OH-12
【解析】
试题(1)加入的Na2CO3、NaOH、BaCl2分别除去Ca2+、Mg2+、SO42—,为了除去干净,试剂需加入过量,过量的Ba2+用后加入的Na2CO3,所以加入试剂的顺序只需要将Na2CO3放在BaCl2后面即可,后用盐酸除去多余的Na2CO3和NaOH;(2)电解饱和食盐水阴极反应为2H++2e—==H2↑,阳极反应式为2Cl——2e—=Cl2↑,总方程式为2Cl-+2H2O![]() H2↑+Cl2↑+2;
H2↑+Cl2↑+2;
n(H2)=n(Cl2)=44.8÷22.4×10-3÷2=10-3mol,n(OH-)=2n(H2)=2×10-3mol
c(OH-)=2×10-3÷0.2=10-2,pH=12


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于D的下一个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1。试回答:
(1)A元素在周期表中的位置为________、E是________(填元素名称)。
(2)D的单质分子的结构式_______,C元素最高价氧化物的水化物的电子式____。
(3)写出工业上冶炼B单质的化学方程式_______________。
(4)写出CD的溶液中通入氯气的离子方程式________________。
(5)比较B、C、E三种元素形成的简单离子氧化性的强弱:(B、C、E离子用实际离子符号表示)氧化性_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势,如图所示:

(1)该反应为______反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是______(填字母)。
A.改铁片为铁粉 B.增大压强 C.升高温度 D.将稀硫酸改为98%的浓硫酸
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为____极(填“正”或“负”)。铜片上产生的现象为______,该极上发生的电极反应为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基:
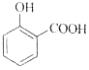 +2HCO3-→
+2HCO3-→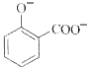 +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ/mol
P(红磷,s)+5/4O2(g)=1/4 P4O10(s) ΔH=-738.5kJ/mol
则白磷转化为红磷的热化学方程式为 ;由此说明红磷的稳定性比白磷 。
(2)明矾[KAl(SO4)2·12H2O]水溶液呈 (填“酸”、“碱”或“中”)性;明矾还能净水,用离子方程式解释其原因为 。
(3)电解池的能量转化形式为 ,原电池反应 (填“一定”或“不一定”)自发。
(4)pH=3的盐酸和pH=3的醋酸溶液各稀释至其体积的100倍,稀释后盐酸的pH (填“大于”、“小于”或“等于”)醋酸的pH;常温时pH=x的盐酸和pH=y的NaOH溶液以1︰10的体积比混合,反应后溶液恰好呈中性,则x、y满足的关系是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SO2+O2![]() 2SO3的叙述不正确的是( )
2SO3的叙述不正确的是( )
A.该反应是可逆反应,在相同条件下,反应可同时向两个方向进行
B.1mol氧气与2mol二氧化硫混合发生反应能生成2mol三氧化硫
C.在该反应中二氧化硫作还原剂,氧气作氧化剂
D.该反应有0.4mol电子发生转移时,生成三氧化硫0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
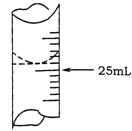
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值,下列说法正确的( )
A. 常温常压下,22.4L的O2含有分子数为NA
B. 标准状况下,22.4L的SO3含有分子数为NA
C. 标准状况下,17gNH3含有的电子数为8 NA
D. 常温常压下,14gC2H4和C3H6的混合物含原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,U形管内盛有150mL的溶液,按要求回答下列问题:
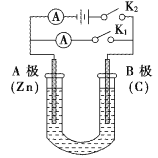
(1)打开K2,闭合K1,若所盛溶液为稀硫酸,则B极为___________极(填电极名称),该装置的能量转化形式为:__________,B极的电极反应式为:______________________。
(2)打开K1,闭合K2,若所盛溶液为NaCl溶液,一段时间后U形管内溶液的pH___________(填“变大”、“不变”或“变小”),总反应的化学方程式是:______________________。若要使U形管内溶液恢复到起始状态,应向U形管内的溶液加入(或通入)___________。
(3)如果要在铁块上镀上铜,打开K1,闭合K2,电解液选用CuSO4溶液,则A电极的材料应换成是___ (填“铁块”或“纯铜”),反应一段时间后电解质溶液中Cu2+的浓度将会_____ (填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com