
【题目】肌红蛋白(Mb)是由肽链和血红素辅基组成的可结合氧的蛋白,广泛存在于肌肉中。肌红蛋白结合氧的反应为:Mb(aq)+O2(g)![]() MbO2(aq)。肌红蛋白的结合度(即转化率α)与氧气分压p(O2)密切相关,37℃时,反应达平衡时测得的一组实验数据如图所示。回答下列问题:
MbO2(aq)。肌红蛋白的结合度(即转化率α)与氧气分压p(O2)密切相关,37℃时,反应达平衡时测得的一组实验数据如图所示。回答下列问题:

(1)37℃时,上述反应的平衡常数K=___________kPa-1(气体和溶液中的溶质分别用分压和物质的量浓度表达);
(2)平衡时,肌红蛋白的结合度α=___________[用含p(O2)和K的代数式表示];37℃时,若空气中氧气分压为20.0kPa,人正常呼吸时α的最大值为___________%结果保留2位小数);
(3)一般情况下,高烧患者体内MbO2的浓度会比其健康时___________(填“高”或“低”);在温度不变的条件下,游客在高山山顶时体内MbO2的浓度比其在山下时___________(填“高”或“低”);
(4)上述反应的正反应速率υ正=k正c(Mb)p(O2),逆反应速率υ逆=k逆c(MbO2)。k正和k逆分别是正向和逆向反应的速率常数。37℃时,上图中坐标为(1.00,50.0)的点对应的反应状态为向___________进行(填“左”或“右”),此时υ正︰υ逆=___________(填数值)。
【答案】2 ![]() 97.56 低 低 右 2
97.56 低 低 右 2
【解析】
按照提示写出平衡常数表达式,代入平衡数据求平衡常数,进而计算转化率;运用平衡移动原理分析温度、压强对化学平衡的影响;用Q与K的关系判断反应的方向;用速率方程与K的关系求速率比。
(1)反应Mb(aq)+O2(g)![]() MbO2(aq)的平衡常数表达式K=
MbO2(aq)的平衡常数表达式K=![]() 。图中,37℃、肌红蛋白结合度为50%时,c(Mb)=c(MbO2)、p(O2)=0.5kPa,求得K=2kPa-1。
。图中,37℃、肌红蛋白结合度为50%时,c(Mb)=c(MbO2)、p(O2)=0.5kPa,求得K=2kPa-1。
(2)平衡时,肌红蛋白的结合度α,则![]() ,代入K表达式得α=
,代入K表达式得α=![]() ;37℃时,将K=2kPa-1、p(O2)=20.0kPa代入,得到α最大值为97.56%。
;37℃时,将K=2kPa-1、p(O2)=20.0kPa代入,得到α最大值为97.56%。
(3)高烧患者体温超过37℃,血液中O2浓度降低,MbO2浓度会比健康时低;高山山顶O2分压比地面低,使Mb(aq)+O2(g)![]() MbO2(aq)左移,MbO2浓度也会降低。
MbO2(aq)左移,MbO2浓度也会降低。
(4)当上述反应达到化学平衡时,有υ正=υ逆,即k正c(Mb)·p(O2)=k逆c(MbO2)。得![]()
![]() =K。
=K。
图中点(1.00,50.0)不在曲线上,37℃时不是化学平衡状态。此时c(Mb)=c(MbO2)、p(O2)=1.00kPa,得Q=1kPa-1<K=2kPa-1,故反应向右进行。υ正︰υ逆=[k正c(Mb)·p(O2)]︰[k逆c(MbO2)]=k正︰k逆=K=2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硫化氢毒性很大,俗称“一口闷”,工业废水中的硫化物在酸性条件下会以硫化氢的形式逸出。某课外小组以碘量法测定废水中的硫化物,实验装置如图所示,实验步骤及测定原理如下:
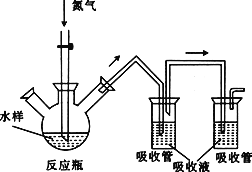
Ⅰ.取样、吹气、固硫
连接装置,打开氮气源,检查装置气密性。移取一定体积1mol·L-1乙酸锌溶液于两支吸收管中,取200mL水样于反应瓶中,通入氮气一段时间。移取10mL盐酸于反应瓶中,水浴加热,继续通入氮气。已知乙酸锌与硫化氢反应生成硫化锌沉淀(硫化氢被完全吸收)。
Ⅱ.滴定
关闭气源,往两个吸收管中各加入0.010mol·L-1的碘标准溶液100mL(过量),再加入盐酸5mL,静置。加入淀粉指示液,用0.010mol·L-1的硫代硫酸钠标准溶液对两支吸收管中的液体进行滴定。(已知:![]() )
)
回答下列问题:
(1)水浴加热的温度不能高于85℃,原因是_____________________________。
(2)加入碘标准溶液时,吸收管中发生反应的化学方程式为________________。
(3)该实验使用两个吸收管的原因是_____________________________,若只使用一个吸收管,会导致测定结果偏______________________(填“高”或“低”)。
(4)该200mL水样经吹气、固硫后,滴定操作时共消耗160mLNa2S2O3溶液,则废水中硫的含量为________mg·L-1。
(5)实验室常用FeS固体与酸反应制取H2S。实验室制取H2S时,从反应物与生成物的状态、性质和反应条件分析,下列发生装置中可选用的是________(填序号)。

(6)将二氧化氯溶液加入硫化氢溶液中,然后加入少量稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马兜铃酸是一种致癌物。如图为马兜铃酸的结构简式,R,R1,R2代表-H,-OH或-OCH3中的一种或几种,下列有关说法正确的是

A. 若R代表—OH,R1,R2代表—H,则对应有机物的分子式为C16H9NO7
B. 若R代表—H,R1,R2代表—OCH3,则对应有机物的结构中含有4种官能团
C. 若R,R1,R2均代表—H,则对应有机物能发生取代反应,氧化反应和水解反应
D. 若R,R1,R2中至少有1个代表—H,则对应的有机物最多有9种结构(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应的△H_____0(填填“>”、“”或“<”)。
②下列措施能用勒夏特列原理解释是______(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500℃左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol NH3溶于水后再与含有0.2mol H2SO4的稀溶液完全反应放热Q kJ,请你用热化学方程式表示其反应式_________________。
(3)原料气H2可通过反应CH4 (g) +H2O (g)![]() CO (g) +3H2(g) 获取,已知该反应中,当初始混合气中的
CO (g) +3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:

①图中,两条曲线表示压强的关系是: P1__P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会______(填“增大”,“减小”或“不变”)。
(4)原料气H2还可通过反应CO (g) +H2O (g)![]() CO2 (g) +H2(g) 获取。T℃时,向容积固定为5L的容器中充入1mol H2O (g) 和1mol CO,反应达平衡后,测得CO的浓度0.08 mol/L,该温度下反应的平衡常数K值为_________。
CO2 (g) +H2(g) 获取。T℃时,向容积固定为5L的容器中充入1mol H2O (g) 和1mol CO,反应达平衡后,测得CO的浓度0.08 mol/L,该温度下反应的平衡常数K值为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿与铜蓝矿都是天然含硫铜矿,在地壳中二者常伴生存在。现取一份该伴生矿样品,经检测后确定仅含Cu2S、CuS和惰性杂质。为进一步确定其中Cu2S、CuS的含量,某同学进行了如下实验:
①取2.6g样品,加入200.0mL0.2000mol·L-1酸性KMnO4溶液,加热(硫元素全部转化为SO42-),滤去不溶杂质;
②收集滤液至250mL容量瓶中,定容;
③取25.00mL溶液,用0.1000mol·L-1FeSO4溶液滴定,消耗20.00mL;
④加入适量NH4HF2溶液(掩蔽Fe3+和Mn2+,使其不再参与其他反应),再加入过量KI固体,轻摇使之溶解并发生反应:2Cu2++4I-=2CuI+I2;
⑤加入2滴淀粉溶液,用0.1000mo1·L-1Na2S2O3溶液滴定,消耗30.00mL(已知:2S2O32-+I2=S4O62-+2I-)。
回答下列问题:
(1)写出Cu2S溶于酸性KMnO4溶液的离子方程式:___________;
(2)配制0.1000mol· L-1FeSO4溶液时要用煮沸过的稀硫酸,原因是___________,配制过程中所需玻璃仪器除了烧杯、玻璃棒、容量瓶外还有___________;
(3)③中取25.00mL待测溶液所用的仪器是___________;
(4)⑤中滴定至终点时的现象为___________;
(5)混合样品中Cu2S和CuS的含量分别为_________%、_________%(结果均保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子二次电池因钠资源丰富、成本低、能量转换效率高等诸多优势有望取代锂离子电池。最近山东大学徐立强教授课题组研究钠离子二次电池取得新进展,电池反应如下:4NaXFeIIFeIII(CN)6+xNi3S2![]() 4FeIIFeIII(CN)6+3xNi+2xNa2S。下列说法正确的是( )
4FeIIFeIII(CN)6+3xNi+2xNa2S。下列说法正确的是( )

A. 放电时,NaXFeIIFeIII(CN)6为正极
B. 放电时,Na+移向Ni3S2/Ni电极
C. 充电时,Na+被还原为金属钠
D. 充电时,阴极反应式:xNa++ FeIIFeIII(CN)6-xe—== NaXFeIIFeIII(CN)6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列说法正确的是
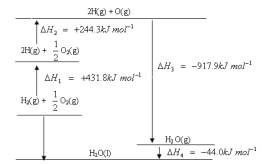
A. H2在O2中燃烧生成气态水的过程中吸收能量
B. 断开1mol H2O(g)所含的共价键共放出917.9kJ的能量
C. H2O(g)比H2O(l)更稳定
D. H2在O2中燃烧生成液态水的热化学方程式为:2H2(g) + O2(g) == 2H2O(l) ![]() H = -571.6 kJ·mol-1
H = -571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写:
(1)二氧化碳的电子式:______________;小苏打的化学式:________________;质子数为6、中子数为6的原子结构示意图____________________。
(2)氯气与氢氧化钠溶液反应的化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,把2.5 mol A和2.5 mol B混合盛入容积为2 L的密闭容器里,发生如下反应:3A(g)+B(s)![]() x C(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
x C(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
A. 反应达到平衡状态时A的转化率为60%
B. x=4
C. 反应达到平衡状态时,相同条件下容器内气体的压强与起始时压强比为6∶5
D. 若混合气体的密度不再变化,则该可逆反应达到化学平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com