
【题目】根据能量变化示意图,下列说法正确的是
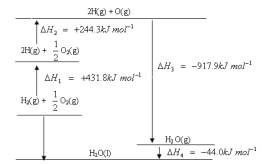
A. H2在O2中燃烧生成气态水的过程中吸收能量
B. 断开1mol H2O(g)所含的共价键共放出917.9kJ的能量
C. H2O(g)比H2O(l)更稳定
D. H2在O2中燃烧生成液态水的热化学方程式为:2H2(g) + O2(g) == 2H2O(l) ![]() H = -571.6 kJ·mol-1
H = -571.6 kJ·mol-1
【答案】D
【解析】
A.反应物的总能量高于生成物的总能量,说明该反应过程放出热量;
B.断开1mol H2O(g)所含的共价键需要吸收能量,而不是放热;
C.能量越低越稳定;
D.根据盖斯定律计算反应热即可,注意反应热的正负号。
A. H2在O2中燃烧生成气态水,从上述图像可以看出,H2(g)+![]() O2(g)的能量大于H2O(g)的能量,因此此反应放出热量,故A项错误;
O2(g)的能量大于H2O(g)的能量,因此此反应放出热量,故A项错误;
B. 断开1mol H2O(g)所含的共价键需要吸收能量,故B项错误;
C. 从图像可以得出,H2O(l)比H2O(g)的能量低,H2O(l)更稳定,故C项错误;
D.根据图像可得,2H2(g) + O2(g) =2H2O(l) ![]() H =2×(△H1+△H2+△H3+△H4)= -571.6 kJ·mol-1,故D项正确;
H =2×(△H1+△H2+△H3+△H4)= -571.6 kJ·mol-1,故D项正确;
答案选D。


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组为探究Na2CO3溶液的性质,需要480mL 0.2molL-1的Na2CO3溶液。溶液的配制过程如图所示:

(1)指出配制过程中两处明显错误_______________.
(2)请分析下列情况对所配溶液浓度产生的影响:其中引起所配溶液浓度偏高的有__________(填序号,下同),偏低的有________,无影响的是________。
①用“左物右码”的方法称量(使用游码);②碳酸钠不纯,其中混有氯化钠;③容量瓶未经干燥使用;④称量碳酸钠时所用砝码生锈;⑤移液过程中有少量溶液溅出;
(3)向标准配制的0.2molL-1的Na2CO3溶液50mL中,逐滴加入0.2molL-1的Ba(OH)2溶液50mL。该过程中发生反应的离子方程式为_____;反应后所得溶液中溶质的物质的量浓度为_____molL-1(忽略溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醛分子的模型,根据该图和所学化学知识回答下列问题:

(1)甲醛分子中碳原子的杂化方式是__________,作出该判断的主要理由是__________________________。
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是________(填序号)。
①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
(3)甲醛分子中C—H键与C—H键间的夹角________(填“=”、“>”或“<”)120°,出现该现象的主要原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肌红蛋白(Mb)是由肽链和血红素辅基组成的可结合氧的蛋白,广泛存在于肌肉中。肌红蛋白结合氧的反应为:Mb(aq)+O2(g)![]() MbO2(aq)。肌红蛋白的结合度(即转化率α)与氧气分压p(O2)密切相关,37℃时,反应达平衡时测得的一组实验数据如图所示。回答下列问题:
MbO2(aq)。肌红蛋白的结合度(即转化率α)与氧气分压p(O2)密切相关,37℃时,反应达平衡时测得的一组实验数据如图所示。回答下列问题:

(1)37℃时,上述反应的平衡常数K=___________kPa-1(气体和溶液中的溶质分别用分压和物质的量浓度表达);
(2)平衡时,肌红蛋白的结合度α=___________[用含p(O2)和K的代数式表示];37℃时,若空气中氧气分压为20.0kPa,人正常呼吸时α的最大值为___________%结果保留2位小数);
(3)一般情况下,高烧患者体内MbO2的浓度会比其健康时___________(填“高”或“低”);在温度不变的条件下,游客在高山山顶时体内MbO2的浓度比其在山下时___________(填“高”或“低”);
(4)上述反应的正反应速率υ正=k正c(Mb)p(O2),逆反应速率υ逆=k逆c(MbO2)。k正和k逆分别是正向和逆向反应的速率常数。37℃时,上图中坐标为(1.00,50.0)的点对应的反应状态为向___________进行(填“左”或“右”),此时υ正︰υ逆=___________(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究Cu(NO3)2 的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.Cu(NO3)2 的氧化性
将光亮的铁丝伸入Cu(NO3)2 溶液中,一段时间后将铁丝取出。为检验溶液中Fe 的氧化产物,将溶液中的Cu2+除尽后,进行了如下实验。可选用的试剂KSCN 溶液、K3[Fe(CN)6]溶液、氯水。
请完成下表:
操作 | 反应或现象 | 结论 |
(1)取少量除尽 Cu2+后的溶液于试管中,加入__溶液,振荡 | 现象____ | 存在 Fe3+ |
(2)取少量除尽 Cu2+后的溶液于试管中,加入 K3[Fe(CN)6]溶液,振荡 | 离子方程式____ | 存在 Fe2+ |
Ⅱ.Cu(NO3)2 的热稳定性
在如图所示的实验装置A 中,用酒精喷灯对Cu(NO3)2 固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为O2。当反应结束以后,试管中残留固体为红色。


(1)装置B 的作用是_______ 。
(2)从实验安全角度考虑,需要在A、B 间加入装置M,请在方框中画出M 装置。_________
(3)下图为Cu(NO3)2 样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。Cu(NO3)2 加热到200℃的化学方程式为___________ ,继续高温至1000℃生成_______(填化学式)固体。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分元素在周期表中的分布如右图所示(虚线为金属元素与非金属元素的分界线),下列说法不正确的是

A. 虚线左侧是金属元素
B. As处于第五周期第VA族
C. Si、Ge可作半导体材料
D. Sb既有金属性又有非金属性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:[FeCl4(H2O)2]-为黄色,下列实验所得结论不正确的是
① | ② | ③ | ④ |
0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
0.1mol/L FeCl3溶液 |
加热前溶液为浅黄色,加热后颜色变深 | 加热前溶液接近无色,加热后溶液颜色无明显变化 | 加入NaCl后,溶液立即变为黄色,加热后溶液颜色变深 | 加热前溶液为黄色,加热后溶液颜色变深 |
注:加热为微热,忽略体积变化。
A. 实验①中,Fe2(SO4)3溶液显浅黄色原因是Fe3+水解产生了少量Fe(OH)3
B. 实验②中,酸化对Fe3+水解的影响程度大于温度的影响
C. 实验③中,存在可逆反应: Fe3+ + 4Cl-+ 2H2O ![]() [FeCl4(H2O)2]-
[FeCl4(H2O)2]-
D. 实验④,可证明升高温度,Fe3+水解平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是
A. 甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa 下,将0.5 mol N2 和 1.5 mol H2 置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-38.6 kJ·mol-1
2NH3(g)ΔH=-38.6 kJ·mol-1
C. 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为:H2(g)+![]() O2(g)
O2(g)![]() H2O(g) ΔH=-242 kJ/mol
H2O(g) ΔH=-242 kJ/mol
D. CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+283.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com