
【题目】如图是甲醛分子的模型,根据该图和所学化学知识回答下列问题:

(1)甲醛分子中碳原子的杂化方式是__________,作出该判断的主要理由是__________________________。
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是________(填序号)。
①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
(3)甲醛分子中C—H键与C—H键间的夹角________(填“=”、“>”或“<”)120°,出现该现象的主要原因是____________________________________________。
【答案】sp2 甲醛分子的空间构型为平面三角形 ②⑤ < 碳氧双键中存在π键,它对C—H键的排斥作用较强
【解析】
(1) 甲醛分子为平面三角形,甲醛分子中的碳原子采用sp2杂化;
(2)醛类分子中都含有C=O键,所以甲醛分子中的碳氧键是双键,双键中含有σ键和π键;
(3)由于碳氧双键中存在π键,它对C—H键的排斥作用较强,键角小于120°。
(1)原子的杂化轨道类型不同,分子的空间构型也不同。由图可知,甲醛分子为平面三角形,所以甲醛分子中的碳原子采用sp2杂化;综上所述,本题答案是:sp2 ;甲醛分子的空间构型为平面三角形。
(2)醛类分子中都含有C=O键,所以甲醛分子中的碳氧键是双键;一般来说,双键是σ键和π键的组合,②⑤正确;综上所述,本题答案是:②⑤。
(3)由于碳氧双键中存在π键,它对C—H键的排斥作用较强,所以甲醛分子中C—H键与C—H键间的夹角小于120°;综上所述,本题答案是:< ,碳氧双键中存在π键,它对C—H键的排斥作用较强。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种元素①X、Y、Z的单质在常温下均为气体;②X单质可以在Z单质中燃烧,生成物为XZ,其中火焰为苍白色;③XZ极易溶于水,电离出X+和Z﹣,其水溶液可使蓝色石蕊试液变红;④每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体;⑤Z单质溶于X2Y中所得溶液具有漂白作用。
(1)推断元素符号X_____、Y_____、Z_____;
(2)化合物XZ的电子式为_____,X2Y属于_____(填离子化合物、共价化合物、共价分子);
(3)写出XZ(写化学式)的电离方程式_____;写出XZ(写化学式)与Ca(ClO)2反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiNiO2是一种前景很好的锂离子电池正极材料。当温度高于850°C时,LiNiO2会分解。请按要求回答下列问题:
(1)LiNiO2中Ni的化合价为___________,工业上用Ni(OH)2与LiOH的混合物在空气流中加热到700~800°C制得 LiNiO2,该反应的化学方程式为___________,加热温度不宜过高的原因是_________,工业上也可用LiNO3代替上述工艺中的LiOH,存在的缺点可能是_______。
(2)以废旧二次电池为原料回收利用合成Ni(OH)2的工艺如下:

已知:酸浸后滤液中含有Ni2+、Al3+、Fe3+、Mn2+;
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33,Ksp[Ni(OH)2]=1.6×10-14;
①滤渣Ⅱ为___________。
②“氧化除锰”是将锰元素最终转化为MnO2而除去,反应历程如下:
i.5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+;
ii.______________________(用离子方程式表示)。
③转化操作后,还需经过过滤、洗涤、烘干得到产品。检验Ni(OH)2是否洗涤干净的实验操作是___________。
④调pH=5操作时,已知溶液中Ni2+浓度为2.0mol/L,则“滤渣II”中是否存在Ni(OH)2沉淀?___________(列式计算,并使用必要的文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马兜铃酸是一种致癌物。如图为马兜铃酸的结构简式,R,R1,R2代表-H,-OH或-OCH3中的一种或几种,下列有关说法正确的是

A. 若R代表—OH,R1,R2代表—H,则对应有机物的分子式为C16H9NO7
B. 若R代表—H,R1,R2代表—OCH3,则对应有机物的结构中含有4种官能团
C. 若R,R1,R2均代表—H,则对应有机物能发生取代反应,氧化反应和水解反应
D. 若R,R1,R2中至少有1个代表—H,则对应的有机物最多有9种结构(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF![]() 的立体构型为________;
的立体构型为________;
②在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(2)①Y2X2(C2H2)分子中Y原子轨道的杂化类型为______,1 mol Y2X2含有σ键的数目为______。
②元素Y(C)的一种氧化物与元素Z(N)的一种氧化物互为等电子体,元素Z的这种氧化物的分子式为________。
③化合物ZX3(NH3)的沸点比化合物YX4(CH4)的高,其主要原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应的△H_____0(填填“>”、“”或“<”)。
②下列措施能用勒夏特列原理解释是______(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500℃左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol NH3溶于水后再与含有0.2mol H2SO4的稀溶液完全反应放热Q kJ,请你用热化学方程式表示其反应式_________________。
(3)原料气H2可通过反应CH4 (g) +H2O (g)![]() CO (g) +3H2(g) 获取,已知该反应中,当初始混合气中的
CO (g) +3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:

①图中,两条曲线表示压强的关系是: P1__P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会______(填“增大”,“减小”或“不变”)。
(4)原料气H2还可通过反应CO (g) +H2O (g)![]() CO2 (g) +H2(g) 获取。T℃时,向容积固定为5L的容器中充入1mol H2O (g) 和1mol CO,反应达平衡后,测得CO的浓度0.08 mol/L,该温度下反应的平衡常数K值为_________。
CO2 (g) +H2(g) 获取。T℃时,向容积固定为5L的容器中充入1mol H2O (g) 和1mol CO,反应达平衡后,测得CO的浓度0.08 mol/L,该温度下反应的平衡常数K值为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿与铜蓝矿都是天然含硫铜矿,在地壳中二者常伴生存在。现取一份该伴生矿样品,经检测后确定仅含Cu2S、CuS和惰性杂质。为进一步确定其中Cu2S、CuS的含量,某同学进行了如下实验:
①取2.6g样品,加入200.0mL0.2000mol·L-1酸性KMnO4溶液,加热(硫元素全部转化为SO42-),滤去不溶杂质;
②收集滤液至250mL容量瓶中,定容;
③取25.00mL溶液,用0.1000mol·L-1FeSO4溶液滴定,消耗20.00mL;
④加入适量NH4HF2溶液(掩蔽Fe3+和Mn2+,使其不再参与其他反应),再加入过量KI固体,轻摇使之溶解并发生反应:2Cu2++4I-=2CuI+I2;
⑤加入2滴淀粉溶液,用0.1000mo1·L-1Na2S2O3溶液滴定,消耗30.00mL(已知:2S2O32-+I2=S4O62-+2I-)。
回答下列问题:
(1)写出Cu2S溶于酸性KMnO4溶液的离子方程式:___________;
(2)配制0.1000mol· L-1FeSO4溶液时要用煮沸过的稀硫酸,原因是___________,配制过程中所需玻璃仪器除了烧杯、玻璃棒、容量瓶外还有___________;
(3)③中取25.00mL待测溶液所用的仪器是___________;
(4)⑤中滴定至终点时的现象为___________;
(5)混合样品中Cu2S和CuS的含量分别为_________%、_________%(结果均保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列说法正确的是
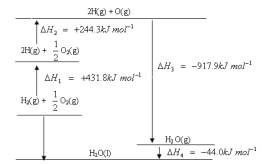
A. H2在O2中燃烧生成气态水的过程中吸收能量
B. 断开1mol H2O(g)所含的共价键共放出917.9kJ的能量
C. H2O(g)比H2O(l)更稳定
D. H2在O2中燃烧生成液态水的热化学方程式为:2H2(g) + O2(g) == 2H2O(l) ![]() H = -571.6 kJ·mol-1
H = -571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中,反应A+2B![]() C分别在三种不同实验条件下进行,它们的起始状态均为c(A) = 0.100 mol·L-1 c(B) = 0.200 mol·L-1 、c(C) = 0 mol·L-1 。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是
C分别在三种不同实验条件下进行,它们的起始状态均为c(A) = 0.100 mol·L-1 c(B) = 0.200 mol·L-1 、c(C) = 0 mol·L-1 。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是

A. 反应的平衡常数:①<② B. 反应A+2B![]() C的△H >0
C的△H >0
C. 实验②平衡时B的转化率为60% D. 实验③平衡时c(C) = 0.04 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com