
【题目】为了探究Cu(NO3)2 的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.Cu(NO3)2 的氧化性
将光亮的铁丝伸入Cu(NO3)2 溶液中,一段时间后将铁丝取出。为检验溶液中Fe 的氧化产物,将溶液中的Cu2+除尽后,进行了如下实验。可选用的试剂KSCN 溶液、K3[Fe(CN)6]溶液、氯水。
请完成下表:
操作 | 反应或现象 | 结论 |
(1)取少量除尽 Cu2+后的溶液于试管中,加入__溶液,振荡 | 现象____ | 存在 Fe3+ |
(2)取少量除尽 Cu2+后的溶液于试管中,加入 K3[Fe(CN)6]溶液,振荡 | 离子方程式____ | 存在 Fe2+ |
Ⅱ.Cu(NO3)2 的热稳定性
在如图所示的实验装置A 中,用酒精喷灯对Cu(NO3)2 固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为O2。当反应结束以后,试管中残留固体为红色。


(1)装置B 的作用是_______ 。
(2)从实验安全角度考虑,需要在A、B 间加入装置M,请在方框中画出M 装置。_________
(3)下图为Cu(NO3)2 样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。Cu(NO3)2 加热到200℃的化学方程式为___________ ,继续高温至1000℃生成_______(填化学式)固体。
 。
。
【答案】KSCN 溶液变红 3Fe2++2[Fe(CN)6]2-= Fe3[Fe(CN)6]2↓ 除去NO2 ![]() 2Cu(NO3)2=2CuO+4NO2↑+O2↑ Cu2O
2Cu(NO3)2=2CuO+4NO2↑+O2↑ Cu2O
【解析】
Ⅰ.铁离子与硫氰酸钾溶液反应生成血红色溶液验证铁离子的存在;亚铁离子的检验是K3[Fe(CN)6]溶液和亚铁离子结合生成蓝色沉淀,据此进行解答;
Ⅱ.(2)根据题意装置A中用酒精喷灯强热,产生红棕色气体为二氧化氮,在装置C中收集到无色气体,可知装置B中二氧化氮与氢氧化钠溶液发生反应;
(3)为了防止C装置中的液体到吸入发生装置A,需要在A、B 间加入安全瓶,有缓冲作用;
(4)根据M(Cu(NO3)2)×w%=固体产物的摩尔质量或倍数求出摩尔质量,然后求出分子式,据实验可知还有产物二氧化氮与氧气,然后书写方程式。
Ⅰ.取少量除尽Cu2+后的溶液于试管中,加入KSCN溶液,振荡,若含有铁离子溶液会变血红色,验证亚铁取少量除尽Cu2+后的溶液于试管中,加入K3[Fe(CN)6]溶液,K3[Fe(CN)6]和亚铁离子反应生成蓝色沉淀,方程式为:2[Fe(CN)6]3-+3Fe2+═Fe3[Fe(CN)6]2↓;
Ⅱ.(2)装置B的作用是除去混合气体中的NO2;
(3)安全瓶中导气管略露出胶塞,如图:![]() ,可以防止C装置中的液体到吸入发生装置A;
,可以防止C装置中的液体到吸入发生装置A;
(4)Cu(NO3)2加热到200℃时,M(Cu(NO3)2)×w%=188g/mol×42.6%=80g/mol,恰好是CuO的摩尔质量,据实验可知还有产物二氧化氮与氧气,方程式为:![]() ;继续高温至1000℃时,M(Cu(NO3)2)×w%=188g/mol×38.3%=72g/mol,恰好是固体Cu2O的摩尔质量的一半,故产物为固体Cu2O。
;继续高温至1000℃时,M(Cu(NO3)2)×w%=188g/mol×38.3%=72g/mol,恰好是固体Cu2O的摩尔质量的一半,故产物为固体Cu2O。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】下列有关有机物的构型判断错误的是
A. 甲烷是正四面体结构,烷烃的碳原子呈直线形
B. 乙烯是平面结构,四个氢原子和二个碳原子共面
C. 苯分子中碳原子采用sp2杂化,得到平面正六边形结构
D. 氨气分子的空间构型为三角锥形,氮原子杂化方式为SP3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF![]() 的立体构型为________;
的立体构型为________;
②在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(2)①Y2X2(C2H2)分子中Y原子轨道的杂化类型为______,1 mol Y2X2含有σ键的数目为______。
②元素Y(C)的一种氧化物与元素Z(N)的一种氧化物互为等电子体,元素Z的这种氧化物的分子式为________。
③化合物ZX3(NH3)的沸点比化合物YX4(CH4)的高,其主要原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿与铜蓝矿都是天然含硫铜矿,在地壳中二者常伴生存在。现取一份该伴生矿样品,经检测后确定仅含Cu2S、CuS和惰性杂质。为进一步确定其中Cu2S、CuS的含量,某同学进行了如下实验:
①取2.6g样品,加入200.0mL0.2000mol·L-1酸性KMnO4溶液,加热(硫元素全部转化为SO42-),滤去不溶杂质;
②收集滤液至250mL容量瓶中,定容;
③取25.00mL溶液,用0.1000mol·L-1FeSO4溶液滴定,消耗20.00mL;
④加入适量NH4HF2溶液(掩蔽Fe3+和Mn2+,使其不再参与其他反应),再加入过量KI固体,轻摇使之溶解并发生反应:2Cu2++4I-=2CuI+I2;
⑤加入2滴淀粉溶液,用0.1000mo1·L-1Na2S2O3溶液滴定,消耗30.00mL(已知:2S2O32-+I2=S4O62-+2I-)。
回答下列问题:
(1)写出Cu2S溶于酸性KMnO4溶液的离子方程式:___________;
(2)配制0.1000mol· L-1FeSO4溶液时要用煮沸过的稀硫酸,原因是___________,配制过程中所需玻璃仪器除了烧杯、玻璃棒、容量瓶外还有___________;
(3)③中取25.00mL待测溶液所用的仪器是___________;
(4)⑤中滴定至终点时的现象为___________;
(5)混合样品中Cu2S和CuS的含量分别为_________%、_________%(结果均保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就转移、定容,所配制的溶液浓度偏大
B. 用广泛pH试纸测得氯水的pH为3
C. 用托盘天平称取5.86g食盐
D. 用细铁丝放在酒精灯火焰上灼烧至无色,然后蘸取少量待测液,透过蓝色钴玻璃观察火焰呈紫色,说明待测液中一定含有K+,没有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列说法正确的是
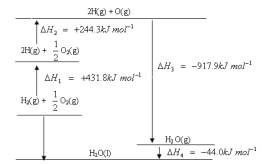
A. H2在O2中燃烧生成气态水的过程中吸收能量
B. 断开1mol H2O(g)所含的共价键共放出917.9kJ的能量
C. H2O(g)比H2O(l)更稳定
D. H2在O2中燃烧生成液态水的热化学方程式为:2H2(g) + O2(g) == 2H2O(l) ![]() H = -571.6 kJ·mol-1
H = -571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:X(g)+2Y(g)![]() 3Z(g) △H=-akJ·mol-1(a>0)。下列说法正确的是
3Z(g) △H=-akJ·mol-1(a>0)。下列说法正确的是
A. 达到平衡状态时,放出的热量一定小于a kJ
B. 向体系中加入X(g)时,正、逆反应速率一定都增大
C. 当容器内的压强保持不变时,则反应一定达到平衡状态
D. 若Y与Z的物质的量之比保持不变,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证某单质与某浓酸在加热条件下反应生成气体甲和乙的成分,某同学设计了如下实验装置图,其中A装置用于检验气体甲:

(1)写出该非单质与浓酸反应的化学方程式:___________________________________。
(2)证明气体中含有乙的实验现象是___________________________________________。
(3)为除去甲,收集纯净干燥的气体乙,某同学欲选用下列装置:

则按气流从左到右,各接口连接顺序正确的是______________。
A.dcabh B.feabh C.feabg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数K(300℃)____________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=____________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是____________。
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
(3)在一定温度的条件下,进一步提高HCI的转化率的方法是______________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
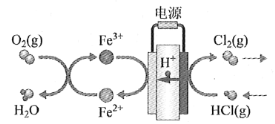
负极区发生的反应有____________________(写反应方程式)。电路中转移1 mol电子,需消耗氧气__________L(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com