
【题目】下列有关有机物的构型判断错误的是
A. 甲烷是正四面体结构,烷烃的碳原子呈直线形
B. 乙烯是平面结构,四个氢原子和二个碳原子共面
C. 苯分子中碳原子采用sp2杂化,得到平面正六边形结构
D. 氨气分子的空间构型为三角锥形,氮原子杂化方式为SP3
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol/L盐酸滴入20.00 mL 1.000 mo1/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是( )
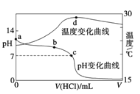
A. a点由水电离出的c(H+) = 1.0 × 10-14 mo1/L
B. b点:c(NH4+) > c(Cl-) > c(OH-) > c(H+)
C. c点:盐酸与氨水恰好完全反应
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(g)+ 2B(g)![]() C(g)+2D(s),经测定,在不同温度下该反应的平衡常数如下:
C(g)+2D(s),经测定,在不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 30 | 15.78 | 12.5 |
(1)该反应为__________反应(填“吸热”“放热”).平衡常数K的表达式为K=____________
(2)假设该反应在恒容绝热的密闭容器中进行,下列能判断该反应已达化学平衡状态的是________;
①容器中压强不变 ② 混合气体中c(A)不变 ③υ正(B)=υ逆(A) ④ 容器内温度不变
⑤容器中混合气体的密度不变 ⑥ c(A):c(b):c(c)=1:2:1
A.除③以外 B.②④⑤ C.①②④⑤ D. ①②④⑤⑥
(3)欲提高B的转化率并加快化学反应速率,下列措施可行的是_____________。(填字母)
a.在恒压下中再充入He b.在恒容下再充入A
c.改变反应的催化剂 d.升高温度
(4)若某温度下,该反应达到平衡时测得反应物与生成物的浓度为c(A)=0.4mol·L-1、c(B)=0.4 mol·L-1、c(C)=0.8 mol·L-1, 则此时的温度为___________;
(5)某温度下,在体积固定的1L的密闭容器中将2 mol A和2 mol B混合,测得不同时刻的压强关系如下:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 |
总压强p/MPa | 20 | 18 | 16.5 | 15 | 12.5 | 12.5 |
①计算反应到2h时υ(A)=________________
②计算平衡时B的转化率为 __________,该温度下反应的平衡常数值________。
③由总压强p和起始压强p0表示反应体系的总物质的量n(总)和生成物C的物质的量n(C),则 n(总 )=___________mol,n(C)=___________mol,反应物A的转化率α(A)的表达式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是化合反应,又是氧化还原反应的是( )
A.2CO+O2![]() 2CO2B.CaO+H2O=Ca(OH)2
2CO2B.CaO+H2O=Ca(OH)2
C.C+H2O![]() CO+H2D.CO2+Ca(OH)2=CaCO3↓+H2O
CO+H2D.CO2+Ca(OH)2=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氧化铝基废催化剂(主要成分为Al2O3,还含有少量Pd)回收Al2(SO4)3及Pd的流程如下:

(1)Al2(SO4)3溶液蒸干灼烧后所得物质的化学名称是___________。
(2)焙烧时Al2O3与(NH4)2SO4反应的化学方程式为___________。
水浸与中和步骤得到溶液的操作方法是___________。
(3)浸液Y中含Pd元素的溶质是___________ (填化学式)。
(4)“热还原”中每生成1molPd生成的气体的物质的量为___________ (已知热还原得到的固体只有Pd)。
(5)Pd是优良的储氢金属,其储氢原理为2Pd(s)+xH2(g)==2PdHx(s),其中x的最大值为0.8。已知: Pd的密度为12g·cm-3, 则10.6cm3Pd能储存标准状况下H2的最大体积为___________L。
(6)铝的阳极氧化法是将铝作为阳极,置于硫酸等电解液中,加入α-羟基丙酸、丙三醇后进行电解,可观察到铝的表面会形成一层致密的氧化膜。
①写出电解时阳极的电极反应式:______________________ 。
②电解过程中α-羟基丙酸、丙三醇的作用可能是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为探究Na2CO3溶液的性质,需要480mL 0.2molL-1的Na2CO3溶液。溶液的配制过程如图所示:

(1)指出配制过程中两处明显错误_______________.
(2)请分析下列情况对所配溶液浓度产生的影响:其中引起所配溶液浓度偏高的有__________(填序号,下同),偏低的有________,无影响的是________。
①用“左物右码”的方法称量(使用游码);②碳酸钠不纯,其中混有氯化钠;③容量瓶未经干燥使用;④称量碳酸钠时所用砝码生锈;⑤移液过程中有少量溶液溅出;
(3)向标准配制的0.2molL-1的Na2CO3溶液50mL中,逐滴加入0.2molL-1的Ba(OH)2溶液50mL。该过程中发生反应的离子方程式为_____;反应后所得溶液中溶质的物质的量浓度为_____molL-1(忽略溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应2SO2(g)+O2(g) 2SO3(g) △H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,针对图像下列分析正确的是

A.图I研究的是t1时刻升高温度对反应速率的影响
B.图I研究的是加入合适催化剂对反应速率的影响
C.图II研究的是t1时刻通入氦气(保持恒容)对反应速率的影响
D.图III研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《新修本草》中关于“青矾”的描述:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中说:“青矾厂气熏人,衣服当之易烂,栽木不茂”,下列相关叙述不正确的是
A. 赤色固体可能是Fe2O3
B. 青矾宜密闭保存,防止氧化变质
C. 青矾燃烧过程中发生了电子转移
D. “青矾厂气”可能是CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究Cu(NO3)2 的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.Cu(NO3)2 的氧化性
将光亮的铁丝伸入Cu(NO3)2 溶液中,一段时间后将铁丝取出。为检验溶液中Fe 的氧化产物,将溶液中的Cu2+除尽后,进行了如下实验。可选用的试剂KSCN 溶液、K3[Fe(CN)6]溶液、氯水。
请完成下表:
操作 | 反应或现象 | 结论 |
(1)取少量除尽 Cu2+后的溶液于试管中,加入__溶液,振荡 | 现象____ | 存在 Fe3+ |
(2)取少量除尽 Cu2+后的溶液于试管中,加入 K3[Fe(CN)6]溶液,振荡 | 离子方程式____ | 存在 Fe2+ |
Ⅱ.Cu(NO3)2 的热稳定性
在如图所示的实验装置A 中,用酒精喷灯对Cu(NO3)2 固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为O2。当反应结束以后,试管中残留固体为红色。


(1)装置B 的作用是_______ 。
(2)从实验安全角度考虑,需要在A、B 间加入装置M,请在方框中画出M 装置。_________
(3)下图为Cu(NO3)2 样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。Cu(NO3)2 加热到200℃的化学方程式为___________ ,继续高温至1000℃生成_______(填化学式)固体。
 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com