
����Ŀ�������Ȼ�ѧ����ʽ��ȷ����
A. ����ı�ȼ����Ϊ890.3 kJ��mol��1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)��2O2(g)===CO2(g)��2H2O(g)����H����890.3 kJ��mol��1
B. 500 �桢30 MPa �£���0.5 mol N2 �� 1.5 mol H2 �����ܱ������г�ַ�Ӧ����NH3(g)������19.3 kJ�����Ȼ�ѧ����ʽΪ��N2(��)+3H2(g) ![]() 2NH3(g)��H����38.6 kJ��mol��1
2NH3(g)��H����38.6 kJ��mol��1
C. ��֪��120 �桢101 kPa�£�1 g H2ȼ������ˮ�����ų�121 kJ���������Ȼ�ѧ����ʽΪ��H2(g)��![]() O2(g)
O2(g)![]() H2O(g)����H����242 kJ/mol
H2O(g)����H����242 kJ/mol
D. CO(g)��ȼ������283.0 kJ��mol��1����2CO2(g)===2CO(g)��O2(g)��Ӧ�Ħ�H��+283.0 kJ��mol��1
���𰸡�C
��������
A.ȼ��������һ�������£�1mol��ȼ����ȫȼ�������ȶ���������ʱ���ų��������������ȼ����Ϊ890.3kJmol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪCH4��g��+2O2��g���T2CO2��g��+2H2O��l����H=-890.3kJmol-1��ˮ��������̬����A����
B.���ĺϳ�Ϊ���淴Ӧ��0.5 molN2��1.5molH2�����ܱ������г�ַ�Ӧ����NH3(g)������19.3kJ����ӦN2(��)+3H2(g) ![]() 2NH3(g)�ķ�Ӧ����H����38.6kJ��mol��1����B����
2NH3(g)�ķ�Ӧ����H����38.6kJ��mol��1����B����
C.1gH2ȼ������ˮ�����ų�121kJ��������1molH2ȼ�շ���242kJ�������Ȼ�ѧ����ʽΪ��H2(g)��1/2O2(g)![]() H2O(g) ��H����242kJ/mol����C��ȷ��
H2O(g) ��H����242kJ/mol����C��ȷ��
D.CO(g)��ȼ������283.0kJ��mol��1����CO(g)��1/2O2(g)=CO2(g) ��H����283.0 kJ��mol��1����2CO2(g)=2CO(g)��O2(g)��Ӧ����H��+2��283.0kJ��mol��1������Ӧʱ��Ӧ�ȵ���ֵ��ȣ������෴����D����
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ���°����ͼΪ��������Ľṹ��ʽ��R��R1��R2����-H��-OH��-OCH3�е�һ�ֻ��֣������й�˵����ȷ����

A. ��R������OH��R1��R2������H�����Ӧ�л���ķ���ʽΪC16H9NO7
B. ��R������H��R1��R2������OCH3�����Ӧ�л���Ľṹ�к���4�ֹ�����
C. ��R��R1��R2��������H�����Ӧ�л����ܷ���ȡ����Ӧ��������Ӧ��ˮ�ⷴӦ
D. ��R��R1��R2��������1��������H�����Ӧ���л��������9�ֽṹ(�����������칹)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������仯ʾ��ͼ������˵����ȷ����
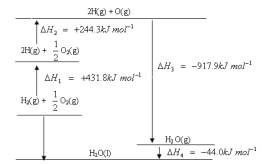
A. H2��O2��ȼ��������̬ˮ�Ĺ�������������
B. �Ͽ�1mol H2O(g)�����Ĺ��ۼ����ų�917.9kJ������
C. H2O(g)��H2O(l)���ȶ�
D. H2��O2��ȼ������Һ̬ˮ���Ȼ�ѧ����ʽΪ��2H2(g) + O2(g) == 2H2O(l) ![]() H = -571.6 kJ��mol-1
H = -571.6 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����д��
��1��������̼�ĵ���ʽ��______________��С�մ�Ļ�ѧʽ��________________��������Ϊ6��������Ϊ6��ԭ�ӽṹʾ��ͼ____________________��
��2������������������Һ��Ӧ�Ļ�ѧ����ʽ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤ij������ijŨ���ڼ��������·�Ӧ����������ҵijɷ֣�ijͬѧ���������ʵ��װ��ͼ������Aװ�����ڼ�������ף�

��1��д���÷ǵ�����Ũ�ᷴӦ�Ļ�ѧ����ʽ��___________________________________��
��2��֤�������к����ҵ�ʵ��������___________________________________________��
��3��Ϊ��ȥ�ף��ռ���������������ң�ijͬѧ��ѡ������װ�ã�

�����������ң����ӿ�����˳����ȷ����______________��
A��dcabh B��feabh C��feabg
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ƽ��״̬�ķ�Ӧ��X(s)��3Y(g)![]() 2Z (g)����H��0��Ϊ��ʹƽ��������Z�ķ����ƶ���Ӧѡ���������
2Z (g)����H��0��Ϊ��ʹƽ��������Z�ķ����ƶ���Ӧѡ���������
������ ������ ����ѹ ����ѹ ���Ӵ��� �������Z
A. �٢ۢ� B. �ڢۢ� C. �ڢۢ� D. �ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ�У���ӦA+2B![]() C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼ״̬��Ϊc(A) = 0.100 mol��L-1 c(B) = 0.200 mol��L-1 ��c(C) = 0 mol��L-1 �������������£���Ӧ��A��Ũ����ʱ��ı仯��ͼ��ʾ������˵������ȷ����
C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼ״̬��Ϊc(A) = 0.100 mol��L-1 c(B) = 0.200 mol��L-1 ��c(C) = 0 mol��L-1 �������������£���Ӧ��A��Ũ����ʱ��ı仯��ͼ��ʾ������˵������ȷ����

A. ��Ӧ��ƽ�ⳣ������<�� B. ��ӦA+2B![]() C����H >0
C����H >0
C. ʵ����ƽ��ʱB��ת����Ϊ60% D. ʵ����ƽ��ʱc(C) = 0.04 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2.5 mol A��2.5 mol B���ʢ���ݻ�Ϊ2 L���ܱ�������������·�Ӧ��3A(g)��B(s)![]() x C(g)��2D(g)����5 s��Ӧ��ƽ�⣬�ڴ�5 s��C��ƽ����Ӧ����Ϊ0.2 mol��L��1��s��1��ͬʱ����1 mol D����������������ȷ����
x C(g)��2D(g)����5 s��Ӧ��ƽ�⣬�ڴ�5 s��C��ƽ����Ӧ����Ϊ0.2 mol��L��1��s��1��ͬʱ����1 mol D����������������ȷ����
A. ��Ӧ�ﵽƽ��״̬ʱA��ת����Ϊ60%
B. x=4
C. ��Ӧ�ﵽƽ��״̬ʱ����ͬ�����������������ѹǿ����ʼʱѹǿ��Ϊ6��5
D. �����������ܶȲ��ٱ仯����ÿ��淴Ӧ�ﵽ��ѧƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ����FeCl3��Һʱ����FeCl3�����ܽ���������Һ�У��ټ�ˮϡ��
B. ��Fe3����CuCl2��Һ�м���CuO������pH�ɳ�ȥ��Һ�л��е�Fe3��
C. �����������¯����ʱCaSO4������ת����
D. ��AlCl3��6H2O��SOCl2��ϲ����ȣ��ɵõ���ˮAlCl3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com