
【题目】某温度下,在容积可变的容器中,反应2A(g)+B(g)![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol,2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向左移动的是( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol,2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向左移动的是( )
A.均减半B.均加半C.均增加1molD.均减少1mol
【答案】D
【解析】
在容积可变的恒压容器中,如果物质的量“均减半”或“均加倍”,则容器体积也相应“减半”或“加倍”,A、B、C三物质的浓度都没有改变,平衡不会移动,选项A、B不符合题意;由此可知,如果A、B、C三种物质增减倍数相同,容积也会相应改变,浓度不变,平衡不移动,“均增加1 mol”时,可理解成先分别增加1 mol、0.5mol、1 mol,然后再增加0.5molB,前者平衡不移动,后者导致平衡正向移动,选项C不符合题意;“均减少1 mol”时,可理解成先分别减少1 mol、0.5mol、1mol,然后再减少0.5molB,前者平衡不移动,后者平衡逆向移动,选项D符合题意;
答案选D。


科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中存在如下反应A(g)+3B(g)2C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出下列关系曲线(如图):
Ⅰ.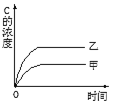 Ⅱ.
Ⅱ.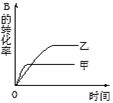 Ⅲ.
Ⅲ.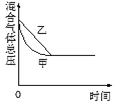
下列判断正确的是( )
①图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
②图Ⅱ研究的是压强对反应的影响,且甲的压强较高
③图Ⅱ研究的是温度对反应的影响,且甲的温度较高
④图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂的效率较高
A.①②B.①③C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图乙是根据图甲的电解池进行电解时某个量(纵坐标x)随时间变化的函数曲线(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),这个量x是表示( )
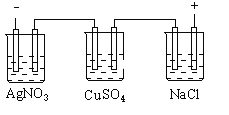
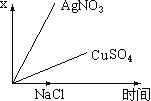
甲 乙
A. 各电池析出气体体积总数的变化B. 各电解池阳极质量的增加
C. 各电解池阴极质量的增加D. 各电极上放电的离子总数的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,水槽中试管内有一枚铁钉,放置数天观察:
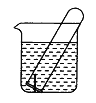
(1)铁钉在逐渐生绣。
(2)若试管内液面上升,发生___腐蚀,正极反应式:___。
(3)若试管内液面下降,正极反应式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式C2H2(g)+![]() O2(g)=2CO2(g)+H2O(g) ΔH=-1256kJ·mol-1,下列说法正确的是( )
O2(g)=2CO2(g)+H2O(g) ΔH=-1256kJ·mol-1,下列说法正确的是( )
A.乙炔的燃烧热为-1256kJ·mol-1
B.若转移10mol电子,则消耗2.5molO2
C.若生成2mol液态水,则ΔH=-2512kJ·mol-1
D.若形成4mol碳氧共用电子对,则放出的热量为2512kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业制备高纯铁。用惰性电极电解FeSO4溶液制备高纯铁的原理如图所示:
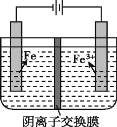
下列说法不正确的是( )
A.阴极主要发生反应:Fe2++2e-=Fe
B.向阳极附近滴加 KSCN 溶液,溶液变红
C.电解一段时间后,阴极附近pH减小
D.电解法制备高纯铁总反应:3Fe2+![]() Fe+2Fe3+
Fe+2Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班学生对BeCl2是离子化合物还是共价化合物进行集体探究,从经验看铍是金属元素,易失去电子,氯元素易得到电子,请回答以下问题:
(1)Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为_________化合物。
(2)工业上制取BeCl2方法是:将得到的BeCl2溶液在HCl气流中蒸干灼烧,防止BeCl2水解,请写出BeCl2水解的化学方程式__________________。
(3)经实验验证,熔融的BeCl2不能导电,说明它是_______化合物;BeCl2能溶于水,水溶液能导电,因它在溶液中能电离,写出它的电离方程式_________。
(4)在周期表中,铍元素和铝元素恰好处于对角线位置,根据对角线法则,判断BeCl2应与_____(填MgCl2或AlCl3)化学性质更相似。
(5)0.1mol氢氧化铍恰好能和100mL0.2mol/L的氢氧化钠溶液发生反应,写出反应的化学方程式_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com