
【题目】硫酸厂的烧渣主要成分是Fe2O3,其次含少量的SiO2和FeS。工业上利用硫酸厂烧渣经回收处理制得绿矾(FeSO4·7H2O)和一种聚铁胶体[Fe(OH)SO4]n。绿矾是治疗缺铁性贫血药品的重要成分,而聚铁胶体是重要的水处理剂。上述生产工艺流程如下:

请通过分析回答下列相关问题:
(1)灼烧产生的尾气对大气有污染,因此工业生产中必须进行回收处理,下列方法可行的是_______________:
A.用氨水吸收 B. 直接用水吸收
C. 用浓硫酸吸收 D. 与空气混合用石灰石粉末悬浊液吸收
(2)操作Ⅲ是_____________、_______________、过滤、洗涤、干燥保存等;
(3)在由溶液X制聚铁胶体过程中①调节pH及②控制温度目的是___________________。
(4)在反应釜中FeS、O2及稀H2SO4反应硫酸铁等物质,则反应的离子方程式为___________________________;
(5)某研究性小组为探究绿矾(相对分子质量:278)在隔绝空气条件下加热分解反应的产物(已知分解产物全为氧化物),进行了如图所示的实验:

① 实验开始时,在点燃C处酒精喷灯之前应先打开活塞通CO2,其目的是_____________。 装置D的作用是______________________。
②该组同学设计的装置存在着一个明显的缺陷是____________________________。
③该组同学称取55.6 g绿矾按上图装置进行实验。待绿矾分解完全后,E瓶中产生了23.3 g白色沉淀。将C中固体产物投入足量稀硫酸中完全溶解得到溶液,取少量该溶液滴入KSCN溶液呈红色;另取少量该溶液滴入酸性KMnO4溶液,KMnO4溶液不褪色。据写出绿矾分解的化学方程式为__________________________。
【答案】(1)AD;(2)蒸发浓缩,冷却结晶;
(3)促使Fe3+充分水解并形成聚铁胶体;
(4)4FeS+3O2+12H+=4Fe3++4S↓+6H2O;
(5)①排尽装置内的空气;防倒吸(或作安全瓶);
②没有尾气处理装置;③2(FeSO4·7H2O)![]() Fe2O3+SO2↑+SO3↑+14H2O。
Fe2O3+SO2↑+SO3↑+14H2O。
【解析】
试题分析:(1)灼烧产生的气体为SO2,SO2是引起酸雨的主要原因, SO2是酸性氧化物,常采用氨水或与石灰石吸收,故选项AD正确;(2)得到晶体,常采用蒸发浓缩、冷却结晶;(3)调节pH的目的是:促使Fe3+充分水解并形成聚铁胶体;(4)根据信息以及流程图,FeS+O2+H2SO4→Fe2(SO4)+S+H2O,Fe元素的化合价由+2价→+3价,化合价升高1价,S的价态由-2价→0价,化合价升高2价,共升高3价,O2中O的化合价由0价→-2价,共降低4价,最小公倍数是12,因此离子反应方程式为:4FeS+ 3O2 + 12H+=4Fe3++ 4S↓+6H2O;(5)①通CO2的目的是排除装置的空气,防止Fe2+被氧气氧化成Fe3+,装置D的作用是起安全瓶的作用;②缺少尾气的处理的装置;③E瓶中沉淀是BaSO4,说明C中产生SO3,即物质的量为n(BaSO4)=n(SO3)=23.3/233mol=0.1mol,将C中固体产物投入足量稀硫酸中完全溶解得到溶液,取少量该溶液滴入KSCN溶液呈红色,推出溶液含有Fe3+,溶液滴入酸性KMnO4溶液,KMnO4溶液不褪色,说明溶液中不含Fe2+,n(FeSO4·7H2O)=55.6/278mol=0.2mol,根据硫元素守恒,因此灼烧后有SO2,且物质的量为0.1mol,因此反应方程式为:2(FeSO4·7H2O) ![]() Fe2O3+SO2↑+SO3↑+14H2O。
Fe2O3+SO2↑+SO3↑+14H2O。


科目:高中化学 来源: 题型:
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:
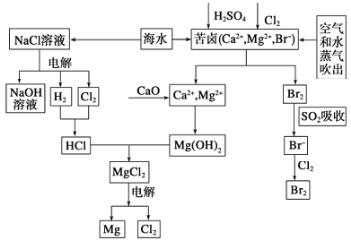
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) ___________________。
(2)①电解饱和食盐水的化学反应方程式为______________。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生的离子方程式_________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为__________________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,最终用_____________方法得到单质Br2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备Na2CO3。下面是他的制备实验过程:
将50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:(I)用25mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;(II)小心煮沸溶液1~2分钟;(III)在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。
(1)(II)中煮沸溶液的目的是 。
(III)中混合另一半NaOH溶液后发生的反应是 。(写离子方程式)
(2)按该同学的设计,第(I)步实验装置如下:
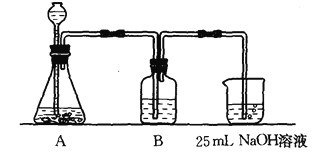
①装置A使用的试剂是 (固体)和 溶液;
②装置B使用的试剂最好是 (选择:水、饱和NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液),作用是 ;写出B中可能发生的离子方程式 ,如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有 。
③有人认为实验步骤(II)、(III)的顺序对调,即先混合,再煮沸,更合理,你认为 (填“合理”或“不合理”)。原因为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
请回答下列问题:
(1)基态Fe原子的价电子排布图为 。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是 ,与CO互为等电子体的分子的分子式为 。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是 ,配体中提供孤对电子的原子是 。
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有 形成。
a.离子键 b.配位键 c.非极性键 d.σ键
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为 ,面心立方堆积与体心立方堆积的两种铁晶体的晶胞单位分别为a pm和b pm,则![]() = 。
= 。
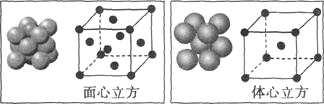
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB![]() cC(s)+dD,当反应进行一段时间后,测得A减少了n mol,B减少了
cC(s)+dD,当反应进行一段时间后,测得A减少了n mol,B减少了![]() mol,C增加了
mol,C增加了![]() n mol,D增加了n mol。此时达到化学平衡状态。
n mol,D增加了n mol。此时达到化学平衡状态。
(1)该化学方程式中各物质的化学计量数:
a=________,b=________,c=________,d=________。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:A________,B____________,D___________。
(3)若只升高温度,反应一段时间后,测得四种物质其物质的量又达到相等,则该反应的正反应为________反应(填“放热”或“吸热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)过氧化钠保存不当容易变质,生成Na2CO3。判断过氧化钠在空气中是否变质的简单方法是观察颜色是否 。
(2)某过氧化钠样品已经部分变质,可以取少量样品,溶解,加入 溶液,充分振荡,看是否有白色沉淀,通过判断溶液中含有碳酸根来证明Na2O2已经变质
(3)检验样品中还有过氧化钠的方法是:取少量样品放入试管中,再加入适量的水,用 ,通过验证反应产生了氧气来证明样品中仍有Na2O2
(4)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。
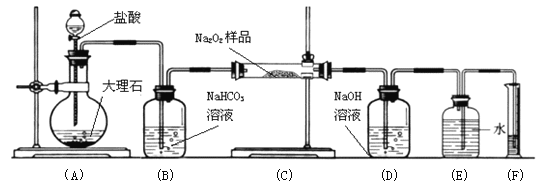
上图中的E和F构成量气装置,用来测定O2的体积。
写出装置A中发生反应的离子方程式:
装置B的作用是除去混在二氧化碳中的氯化氢气体,
NaOH的作用是
他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200 ℃时,11.6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体质量增加了3.6 g。则原混合气体中CO2和H2O的物质的量之比是( )
A.1:4 B.3:11 C.1:11 D.21:22
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对外加电流的金属保护中,被保护的金属( )
A. 与电源的正极相连 B. 表面上发生氧化反应
C. 与电源的负极相连 D. 与另一种活泼性较差的金属相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com