
【题目】下列化学用语的表述正确的是
A. NH4Cl的水解常数表达式:K=![]()
B. NaHCO3水解的离子方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
C. 结构示意图为![]() 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
D. H2SO3的电离方程式:H2SO3![]() 2H++SO32-
2H++SO32-
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】下列解释工业生产或应用的化学用语中,不正确的是
A. FeCl3溶液刻蚀铜电路板:2Fe3++Cu==2Fe2++Cu2+
B. Na2O2用作供氧剂:Na2O2+H2O==2NaOH +O2↑
C. 氯气制漂白液:Cl2+2NaOH==NaCl+NaClO +H2O
D. Na2CO3溶液处理水垢:CaSO4(s)+CO32![]() CaCO3(s)+SO42
CaCO3(s)+SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图甲是一种在微生物作用下将废水中的尿素CO(NH2)2转化为环境友好物质,实现化学能转化为电能的装置,并利用甲、乙两装置实现在铁上镀铜。下列说法中不正确的是

A. 乙装置中溶液颜色不变
B. 铜电极应与Y相连接
C. M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
D. 当N电极消耗0.25 mol气体时,铜电极质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于4NH3(g) + 3O2(g) = 2N2(g) + 6 H2O(g) 的反应来说,以下化学反应速率的表示中反应速率最快的是
A. v(NH3)=0.6 mol L-1min-1B. v(O2) =0.4 mol L-1min-1
C. v(N2)=0.2 mol L-1min-1D. v(H2O) =0.3 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。

A. 200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25 L2/mol2
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的短周期主族元素。X分别与Y、Z、W结合形成质子数相同的甲、乙、丙三种分子。丁为无色气体,遇空气变红棕色;丙的水溶液可刻蚀玻璃。
上述物质有如图转化关系:

下列说法错误的是
A. 四种元素形成的单质中W的氧化性最强
B. 甲、乙、丙中沸点最高的是丙
C. 甲常用作致冷剂
D. 甲、乙分子均只含极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
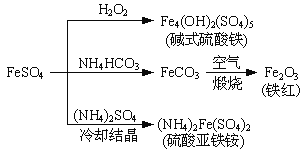
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84g/cm3)配制l00mL 1mol/L的稀硫酸,现绐出下列仪器(配制过程中可能用到):①100mL量筒②10mL量筒③50mL烧杯 ④托盘天平⑤100mL容量瓶⑥胶头滴管⑦玻璃棒,配制中使用仪器的先后順序排列正确的是
A. ④③⑦⑤⑥ B. ②⑤⑦⑥ C. ①③⑤⑥⑦ D. ②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2(g) + CO(g)![]() CO2(g) + NO(g)ΔH=-234 kJ/mol该反应的平衡常数为K1(下同)
CO2(g) + NO(g)ΔH=-234 kJ/mol该反应的平衡常数为K1(下同)
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________;
以及此热化学方程式的平衡常数K=________(用K1、K2、K3表示)。
(2)①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是________。
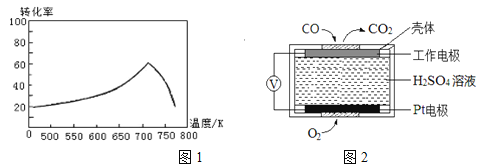
②已知:测定空气中NO和CO含量常用的方法有两种:
方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为____;
方法2:氧化还原滴定法。用H2O2溶液吸收尾气、将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式:________________。
(3)NO2会污染环境,可用Na2CO3溶液吸收NO2 并生成CO2,已知9.2gNO2气体和Na2CO3溶液完全反应时转移电子0.1mol,恰好反应后,使得溶液中的CO2完全逸出,所得溶被呈弱碱性,则溶液中存在的所有离子浓度大小关系是____________________________。
(4)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图I、Ⅱ所示。
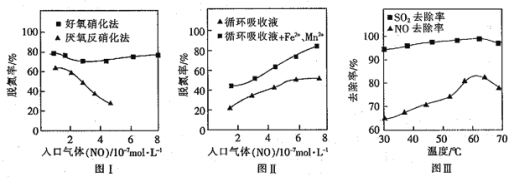
①由图I知,当废气中的NO含量增加时,宜选用___________法提高脱氮的效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+,提高了脱氮的效率,其可能原因为___________。
(5)研究表明:NaClO/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。温度高于60℃后,NO去除率下降的原因为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com