
【题目】下图是半导体光电化学电池光解水制氢的反应原理示意图。在光照下,电子由价带跃迁到导带后,然后流向对电极。下列说法正确的是

A.半导体电极的电极反应式4OH -4e-=2H2O+O2↑
B.电解一段时间后,溶液的pH减少
C.电解质溶液中的阴离子移向半导体电极
D.整个过程中实现了太阳能—化学能—电能
【答案】AC
【解析】
图示分析可知:在对电极上发生的反应是水电离出的氢离子得到电子生成氢气,该电极是正极,电极反应为:2H++2e-=H2↑,则半导体电极是负极,半导体电极的电极反应式4OH--4e=2H2O+O2↑,电解质里的阳离子移向正极,整个过程构成原电池,据此回答。
A.图示分析可知半导体电极的电极反应式4OH--4e=2H2O+O2↑,故A正确;
B.半导体光电化学电池光解水生成氧气和氢气,但电解质溶液酸碱性不知,电解一段时间后,溶液的pH不能确定,故B错误;
C.电解质溶液中阳离子向正极即对电极移动,阴离子移向半导体电极,故C正确;
D.过程分析可知,该装置是光能转化为电能,电能转化为化学能,故D错误;
故选:AC。


科目:高中化学 来源: 题型:
【题目】用如图电解装置将雾霾中的SO2、NO转化为(NH4)2SO4,用其作为一种优良的氮肥。下列有关说法正确的是
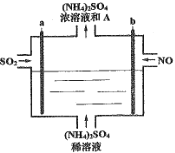
A.a与电源负极相连,发生还原反应
B.每处理lmolNO可以生成2molA
C.通电后阳极附近溶液的pH增大
D.理论上将SO2与NO以体积比2:5通入装置可彻底转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为800℃时A、B、C三种气体在密闭容器中反应时的浓度变化情况,则下列说法错误的是( )

A.发生的反应可表示为2A(g)![]() 3B(g)+C(g)
3B(g)+C(g)
B.前2min,A的分解速率为0.1mol·L-1·min-1
C.2min后反应达到平衡状态
D.2min时,A、B、C的浓度之比为2:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
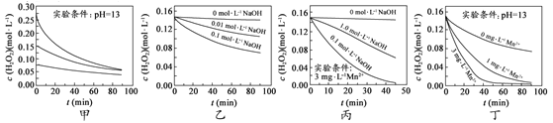
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.  Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B.  正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D.  使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷是重要的元素,能形成多种含氧酸。回答下列问题:
(1)次磷酸(H3PO2)是一元酸,其电离常数的值K=9×103。向10mL0.1 molL-1H3PO2溶液中加入30mL等物质的量浓度的NaOH溶液,写出反应的离子方程式_________,c(Na+)+(H2PO2-)+c(H3PO2)=______(忽略混合后溶波体积的变化)。
(2)亚磷酸(H3PO3)是二元弱酸, 25℃时亚磷酸的电离常数的值为K1=1×10-2、k2=2.6×10-7,则NaH2PO3溶液显性_____(填“酸”“碱”或“中”),原因是____(结合化学用语及数据计算进行解释)
(3)已知HF的电离常数的值为K=3.6×10-4,将足量HF溶液和Na2HPO3溶液反应,其离子方程式为______。
(4)亚磷酸具有强还原性。化学实验小组利用滴定法测定某亚磷酸溶液的浓度,取25.00mL的亚磷酸溶液放入锥形瓶中,用0.10 molL-1的高锰酸钾溶液进行滴定,反应的离子方程式是5H3PO3+ 2MnO4-+6H+ = 5H3PO4+ 2Mn2+ +3H2O。
三次滴定实验的数据分别如下:
实验编号 | 滴定前读数 | 滴定后读数 |
1 | 0.50 | 22.50 |
2 | 1.50 | 24.50 |
3 | 1.00 | 22.00 |
①亚磷酸溶液的物质的量浓度为______。
②关于该实验下列说法正确的是______(填写序号)。
a 取亚磷酸溶液的滴定管,洗涤后未润洗,导致结果偏低
b 盛高锰酸钾溶液的滴定管滴定前有气泡,滴定后无气泡,导致结果偏高
c 滴定过程中眼睛只注视滴定管中液面变化,并做好记录
d 锥形瓶未干燥底部有水,会导致结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3,混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
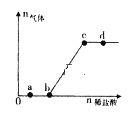
A. a点对应的溶液中:Na+、OH-、SO42-、NO3-
B. b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中:F-、NO3-、Fe2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒“现代工业的味精”,是发展现代工业、现代国防和现代科学技术不可缺少的重要材料,其氧化物二氧化钒(VO2)是一种新型热敏材料,五氧化二钒(V2O5)是接触法生成硫酸的催化剂.下列某化学小组从废钒催化剂(V2O5、V2O4、K2SO4、SiO2、Fe2O3、Al2O3等)中回收V2O5并且利用回收的V2O5制备VO2的氧钒(Ⅳ) 碱式碳酸铵晶体
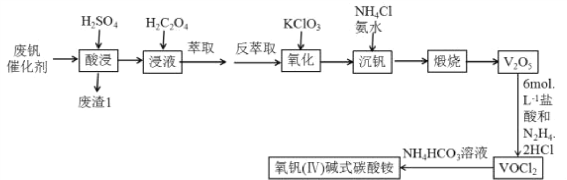
已知:①“酸浸”时V2O5转化为VO2+,V2O4转成VO2+
②有机萃取剂萃取VO2+的能力比萃取VO2+要强。
③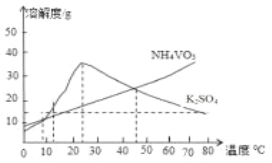
回答下列问题:
(1)写出“废渣1”的主要成分的用途________(填两条)。
(2)“萃取”之前加入H2C2O4的主要目的_____________________。
(3)“氧化”过程中发生的离子方程式___________________________。
(4)该工艺中加入氯化铵“沉钒”是回收钒的关键之一,加入氯化铵、氨水之后的操作是____________,该流程用到了过滤操作,过滤和萃取分液都需用到的一种玻璃仪器是__________。
(5)工艺中生成VOC12的同时生成一种无色无污染的气体,该反应中氧化产物与还原产物的物质的量之比为___________;也可只用浓盐酸与V2O5来制备VOC12 溶液,该方法的化学方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醚是有机合成中常用的溶剂.某实验小组在实验室利用乙醇脱水制备乙醚, 装置示意图( 夹持和加热装置已略去)、有关数据和实验步骤;

物质 | 相对分子质量 | 密度(g/mL) | 沸点(℃) | 在水中的溶解性 |
乙醇 | 46 | 0.816 | 78 | 互溶 |
乙醚 | 74 | 0.713 | 34.6 | 不容 |
已知:①相同条件下,乙醚在饱和食盐水中比在水中更难溶。
②氯化钙可与乙醇形成络合物 CaCl26C2H5OH.
请回答下列问题:
(1)由乙醇制备乙醚的总反应为2CH3CH2OH![]() CH3CH2OCH2CH3 + H2O . 此反应分两步进行,第一步反应的化学方程式 : CH3CH2OH +H2SO4
CH3CH2OCH2CH3 + H2O . 此反应分两步进行,第一步反应的化学方程式 : CH3CH2OH +H2SO4 ![]() CH3CH2OSO2OH + H2O ,则第二步反应的化学方程式为 _____________________________。
CH3CH2OSO2OH + H2O ,则第二步反应的化学方程式为 _____________________________。
(2)仪器 D 中盛有冰水混合物 ,其作用为_____________________________。
(3)操作1 的名称为 ________,操作2 的名称为 ___________。
(4)若省略步骤 II会导致的后果是_________________________________。
(5)若实验过程中加入18mL 乙醇,最终得到 8.7g 乙醚.则乙醚的产率为_____ (计算结果精确到0.1%).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com