
【题目】用阳极 X 和阴极 Y 电解 Z 的水溶液,电解一段时间后,再加入 W,能使溶液恢复到电解前的 状态,则下列不符合题意的一组是
组号 | X | Y | Z | W |
A | C | Fe | NaCl | HCl 气体 |
B | Pt | Cu | CuSO4 | CuO |
C | C | C | H2SO4 | H2O |
D | Ag | Fe | AgNO3 | AgNO3 |
A.AB.BC.CD.D
【答案】D
【解析】
A. C作阳极、Fe作阴极,电解NaCl溶液,电池反应式为2 NaCl +2H2O![]() H2↑+2NaOH+Cl2↑,所以相当于析出HCl,要使电解后溶液恢复原状,应该通入适量HCl,故A符合;
H2↑+2NaOH+Cl2↑,所以相当于析出HCl,要使电解后溶液恢复原状,应该通入适量HCl,故A符合;
B. 以Pt为阳极、Cu为阴极,电解CuSO4溶液,电池反应式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,所以相当于析出CuO,要使溶液恢复原状,需要加入CuO或CuCO3,故B符合;
2Cu+O2↑+2H2SO4,所以相当于析出CuO,要使溶液恢复原状,需要加入CuO或CuCO3,故B符合;
C. 以C作阴阳极,电解稀硫酸溶液,电池反应式为2H2O![]() 2H2↑+O2↑,相当于析出H2O,要使电解后溶液恢复原状,加入适量H2O即可,故C符合;
2H2↑+O2↑,相当于析出H2O,要使电解后溶液恢复原状,加入适量H2O即可,故C符合;
D. 以Ag和Fe为电极,电解AgNO3溶液,相当于电镀银,阳极Ag失电子生成Ag+、阴极Ag+得电子生成Ag,通电一段时间后仍为AgNO3溶液,且浓度不变,不需要加AgNO3固体恢复原样,故D不符合;
答案选D。


科目:高中化学 来源: 题型:
【题目】在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中Fe2(SO4)3与CuSO4的物质的量浓度之比为
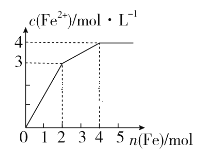
A.3∶1B.1∶2C.2∶1D.1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列说法正确的是
Na2S+2CO2↑。下列说法正确的是
A.4.2g14C原子含中子数目为1.8NA
B.1L0.1mol/LNa2S溶液中含阴离子的数目小于0.1NA
C.该反应中,若生成1mol氧化产物,转移电子数目为4NA
D.常温下2.24LCO2中共用电子对数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
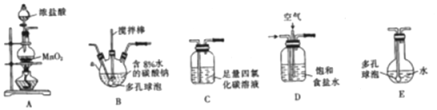
(1)各装置的连接顺序为______→ → →C→ 。
(2)装置B中多孔球泡和搅拌棒的作用是____________________________________ ;装置C的作用是_____________________。
(3)制备Cl2O的化学方程式为________________________。
(4)反应过程中,装置B需放在冷水中,其目的是_____________________________。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol·L-1HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。

试回答:
(1)A点沉淀的化学式为______。
(2)写出A点至B点发生反应的离子方程式_______。
(3)求原混合物中AlCl3的质量____和NaOH的物质的量____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知M是短周期金属元素,X和Y是短周期非金属元素,且X、M、Y的原子序数依次增大。三者组成的物质M3XY(可视为M2XMY)是一种良好的离子导体。研究者在常压下利用下列反应合成M3XY: 2M + 2MXA +2MY==2M3XY +A2。其中常温常压下A2是无色无味气体,已知上述反应中消耗0.92 g M的单质可得到标准状况下448 mL的A2。下列有关说法正确的是
A.简单离子半径:Y>M>X
B.简单氢化物的沸点:X小于Y
C.MXA是共价化合物
D.M3XY溶于水后溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
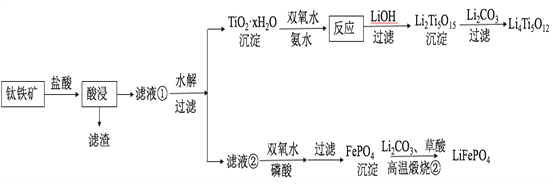
回答下列问题:
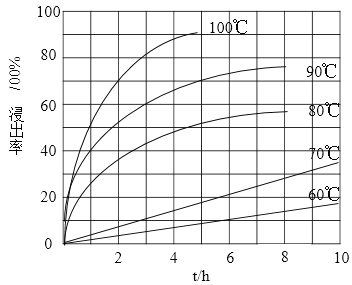
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁的化合物的说法不正确的是
A.实验室为了暂时妥善保存硫酸亚铁溶液,常加入少量的铁粉
B.某溶液若加入KSCN溶液,无变化,但通入Cl2后变血红色,说明原溶液中含有Fe2+
C.欲检验FeSO4溶液是否全部变质,可加入少量酸性高锰酸钾溶液观察紫色是否褪去
D.将适量铁粉放入FeCl3溶液中完全反应后,溶液中Fe2+和Fe3+的浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2OCH3COOH+C2H5OH.已知该反应的速率随c(H+)的增大而加快。如图为CH3COOC2H5的水解速率随时间的变化图。下列说法正确的是( )
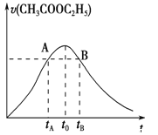
A.反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
B.A、B两点表示的c(CH3COOC2H5)相等
C.图中t0时反应达到平衡状态
D.tB时CH3COOC2H5的转化率低于tA时CH3COOC2H5的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com