


科目:高中化学 来源: 题型:
| A、0.3mol NaCl 溶于100mL水中 |
| B、75mL 1.5mol/L的CaCl2 |
| C、500mL 溶液中含3mol的KCl |
| D、150mL 1mol/L的 NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可能都在第2周期 |
| B、若A在第3周期、则B在第4周期 |
| C、可能都在第3周期 |
| D、若A在第3周期、则B在第2周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:
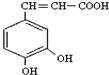 )也叫3,4-二羟基桂皮酸,它存在于许多种药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效.
)也叫3,4-二羟基桂皮酸,它存在于许多种药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效.查看答案和解析>>
科目:高中化学 来源: 题型:
 已知2A2(g)+B2(g)?2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为wmol/L,放出热量Q2kJ.
已知2A2(g)+B2(g)?2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为wmol/L,放出热量Q2kJ.查看答案和解析>>
科目:高中化学 来源: 题型:
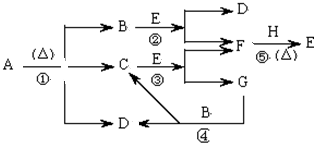
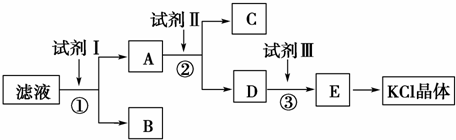
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
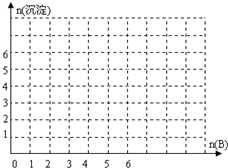
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、200 mL 0.15 mol/L MgSO4 溶液 |
| B、50 mL 0.05 mol/L Al2(SO4)3溶液 |
| C、150 mL 1 mol/L Na2SO4 溶液 |
| D、300 mL 0.5 mol/L CuSO4 溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com