
【题目】关于硝酸叙述正确的是:
A.硝酸不稳定,见光或受热就会分解B.稀硝酸是弱酸,浓硝酸是强酸
C.铜与稀硝酸反应生成二氧化氮D.铁与浓硝酸不反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是

A. 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图2所示,每个F-最近的F-有6个
C. H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动
D. 金属铜中Cu原子堆积模型如图4为最密堆积每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液A 可能含有Na+、Fe3+、Ba2+、NH4+、Cl-、SO42-、HCO3-、HSO3-中的几种离子,溶液中阳离子浓度相同。为了确定其组成,进行如下实验(假设气体全部逸出,忽略H2O2分解)

下列说法不正确的是( )
A. 溶液A 中一定不存在Fe3+、SO42-
B. 溶液A中肯定存在HCO3-、HSO3-、Ba2+、NH4+
C. 溶液A 中一定存在Cl-,且n(Cl-)=0.01mol
D. 溶液A中可能存在Na+,为了确定是否存在,可取溶液通过焰色反应验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种重要的化工原料,温度在350℃以上容易分解。利用反应Ca(s)+O2=CaO2(s),在纯氧条件下,制取CaO2的装置示意图如下:
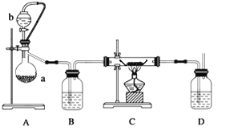
(1)装置A中反应的化学方程式为_________;
(2)装置D中盛有的液体是浓硫酸,其作用一 :____________;二:___________。
(3)仪器安装后应进行的实验操作:
a.通入氧气b.检查装置气密性c.加入药品d.停止通氧气e.点燃酒精灯f.熄灭酒精灯g.冷 却至室温,正确的操作顺序为_____________。
(4)钙在空气中燃烧生成氮化钙(Ca3N2),同时可能生成过氧化钙。请利用下列试剂,设计试验检验钙的燃烧产物中是否含有过氧化钙____________________。(简要说明现象和结论)(限选试剂:酸化的FeCl2溶液、KSCN溶液、稀硝酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G的原子序数依次增大的元素,A、D元素的原子最外层电子数相同,A元素的一种原子没有中子;B的一种同位素可用于考古断代;C是地壳中含量最多的一种元素;D元素的阳离子电子层结构与氖原子相同;E的最外层电子数是电子层数的2倍;F的单质具有强氧化性.G是用途最广泛的金属元素,它的单质能被磁铁所吸引;试回答以下问题:
(1)E的原子结构示意图:____________。
(2)D单质与C单质在加热条件下反应产物的电子式 _______,该物质与A2C反应的离子方程式______。
(3)化合物甲、乙由A、B、C、D中的三种或四种组成的常见物质,且甲、乙的水溶液均呈碱性.则甲、乙反应的化学方程式为____________。
(4)E的最高价氧化物对应水合物的浓溶液加入G单质,下列说法正确的是____________。
A.常温下两者不发生反应 B.常温下无现象 ,G单质不溶解
C.受热能发生反应,开始放出氢气 D. 受热能发生反应,开始放出是SO2
(5)用电子式写出A2C的形成过程___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D的性质或结构信息如下。
信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
|
|
|
是地球上最常见的物质之一,常温为液态,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分 | 无色,无味且易燃,是21世纪的主要能源 | 弱酸,有强氧化性,可以用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)甲、乙、丙中含有的共同元素是 (填名称)。
(2)B元素在周期表中的位置为 。
(3)上述元素的原子M层有一个未成对p电子的是 (填元素符号)。
(4)丙的电子式为 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为 。
【答案】(1)氢(2)第2周期ⅣA族(3)Cl
(4) HClO+H2O+SO2=H2SO4+HCl
HClO+H2O+SO2=H2SO4+HCl
【解析】试题分析:四种短周期元素A、B、C、D,四种元素之间形成甲、乙、丙三种分子,由信息②,甲分子为V型结构,是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分,故甲为水,乙为正四面体结构,无色无味而易燃,是21世纪的主要能源,乙为甲烷,丙分子有3个不同的原子,至少还有C、H、O中的两种,且有强氧化性,可以用于消毒杀菌,丙应是HClO,再根据信息①原子半径大小:A>B>C>D可得,A为Cl元素、B为C元素、C为O元素、D为H元素,据此答题.
解:四种短周期元素A、B、C、D,四种元素之间形成甲、乙、丙三种分子,由信息②,甲分子为V型结构,是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分,故甲为水,乙为正四面体结构,无色无味而易燃,是21世纪的主要能源,乙为甲烷,丙分子有3个不同的原子,至少还有C、H、O中的两种,且有强氧化性,可以用于消毒杀菌,丙应是HClO,再根据信息①原子半径大小:A>B>C>D可得,A为Cl元素、B为C元素、C为O元素、D为H元素,
(1)根据上面的分析可知,甲、乙、丙中含有共同元素是氢元素,
故答案为:氢;
(2)B为碳元素,在周期表中第二周期第IVA族,
故答案为:第二周期第IVA族;
(3)上述元素的原子M层有一个未成对p电子的是氯元素,
故答案为:Cl;
(4)丙为次氯酸,它的电子式为![]() ,次氯酸与SO2水溶液可发生氧化还原反应,生成两种强酸,反应方程式为HClO+H2O+SO2=H2SO4+HCl,
,次氯酸与SO2水溶液可发生氧化还原反应,生成两种强酸,反应方程式为HClO+H2O+SO2=H2SO4+HCl,
故答案为:![]() ;HClO+H2O+SO2=H2SO4+HCl.
;HClO+H2O+SO2=H2SO4+HCl.
【题型】推断题
【结束】
19
【题目】现有部分前36号元素的性质或原子结构如下表
| 元素编号 | 元素性质或原子结构 |
R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
T | 基态原子3d轨道上有1个电子 |
X | |
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是________________________________________________________。
(2)S元素的化合价是否有正价?__________,原因是__________________________________,最外层电子排布式为________________________。
(3)T元素的原子N能层上电子数为__________,其原子结构示意图为__________。
(4)X的核外电子排布图违背了__________。用X单质、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结构决定性质,研究物质的组成、结构对于学习物质的性质至关重要。
(1)如图中每条折线表示周期表ⅣA~ⅦA族中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点、b点分别代表的是 ___________、___________ (写化学式),a比b的沸点高的原因是__________________________________。

(2)在超高压下,科学家用激光器将CO2加热到1800K,成功制得了类似石英的CO2原子晶体。由此推测该CO2晶体中O—C—O键角为__________,与石英相比该晶体的熔点、沸点________(“更高”或“更低”),理由是_________________________________。
(3)利用铜萃取剂M可通过如下反应实现铜离子的富集:


①M所含元素的电负性由大到小顺序为____,其中氮原子以__轨道与氧原子形成σ键。
②M与W(右图)相比,M的水溶性较小,更利于Cu2+的萃取。M水溶性较小的主要原因是___________________________________。
(4)常用![]() 表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为
表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为![]() 。已知吡咯(下图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,请问:吡咯分子中的大π键应表示为________,吡咯分子中N原子的杂化类型为 ________,1mol吡咯分子中所含的σ键数目为________。
。已知吡咯(下图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,请问:吡咯分子中的大π键应表示为________,吡咯分子中N原子的杂化类型为 ________,1mol吡咯分子中所含的σ键数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列粒子比较正确的是( )
A. 还原性:F->Cl- B. 粒子半径:Cl->Cl
C. 粒子半径:Na+>Na D. 氧化性:Na+>Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述正确的是

A. 图甲表示有无催化剂的反应,加催化剂可以改变反应的焓变
B. 图乙表示等浓度等体积的NaCl、NaBr及NaI溶液分别用AgNO3溶液滴定曲线,a为Cl-
C. 图丙表示等浓度等体积的盐酸和醋酸分别用NaOH溶液的滴定曲线,指示剂都可用酚酞
D. 图丁表示反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率b>c>a
N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率b>c>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com