
【题目】对下列粒子比较正确的是( )
A. 还原性:F->Cl- B. 粒子半径:Cl->Cl
C. 粒子半径:Na+>Na D. 氧化性:Na+>Al3+
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】A~J均为有机化合物,它们之间的转化如下图所示:

实验表明:①D既能发生银镜反应,又能与金属钠反应放出氢气:
②核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1;
③G能使溴的四氯化碳溶液褪色;④1mol J与足量金属钠反应可放出22.4L氢气(标准状况)。
请根据以上信息回答下列问题:
(1)A的结构简式为____________(不考虑立体结构),由A生成B的反应类型是____________反应;
(2)D的结构简式为_____________;
(3)由E生成F的化学方程式为_______________,E中官能团有_________(填名称),与E具有相同官能团的E的同分异构体还有________________(写出结构简式,不考虑立体结构);
(4)G的结构简式为_____________________;
(5)由I生成J的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
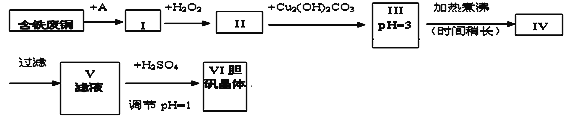
pH值控制可参考下列数据
物 质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
氢氧化铁 | 2.7 | 3.7 |
氢氧化亚铁 | 7.6 | 9.6 |
氢氧化铜 | 5.2 | 6.4 |
请根据上述流程回答下列问题:
(1)A物质可选用_____(填字母)。
a.稀H2SO4 b.浓H2SO4/△ c.浓FeCl3溶液 d.浓HNO3
(2)I中加H2O2的离子方程式________________________________________。
(3)II中加Cu2(OH)2CO3的目的是________________________;其优点是__________。
(4)III加热煮沸时发生的化学反应的离子方程式为________________________。
(5)V中加H2SO4调节pH=1是为了____________________________________________。
(6)V到VI的操作是_________________________________
(7)某同学认为上述流程中所加的A物质并不理想,需作改进,其理由是__________。如何改进___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏钒酸铵(NH4VO3)为白色或微黄色的晶体粉末,微溶于水和氨水,难溶于冷水。
(1)偏钒酸铵在常温下稳定,加热时易分解。它在空气中分解能得到V2O5,试写出偏钒酸铵分解的化学方程式:___________,
(2)五氧化二钒广泛应用于冶金、化工等行业,工业上常用铝热反应制取金属钒,该反应的化学方程式为________,生成1 mol V,需转移的电子的物质的量为____mol。
(3)钒电池是一种活性物质呈循环流动液态的二次电池。某钒电池总反应为VO2++V2++2H+![]() VO2++V3++H2O。
VO2++V3++H2O。
①放电时钒电池的负极反应式为______________。
②用该钒电池在铁制品上镀铜,铁制品应与电池的_____(填“正极”或“负极”)相连。若电镀开始时两电极质量相等,电镀一段时间后,两电极质量之差为128 g,此时转移电子的物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用科学技术减少氮氧化物、SO2等物质的排放,可促进社会主义生态文明建没。
(1)采用“联合脱硫脱氮技术”处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4.Ca(NO3)2的副产品,工业流程如题20图一l所示。

①反应釜I采用“气一液逆流”接触吸收法(如题20图-2),其优点是________________。
②反应釜Il中CaSO3转化为CaSO4的化学反应方程式为 ___________________________。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____________________________________。
(3)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图I、Ⅱ所示。

① 由图I知,当废气中的NO含量增加时,宜选用______法提高脱氮的效率。
② 图Ⅱ中,循环吸收液加入Fe2+、Mn2+,提高了脱氮的效率,其可能原因为________。
(4)研究表明:NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。
①温度高于60℃后,NO去除率下降的原因为__________。
②写出废气中的SO2与NaC1O2反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是

A. 由图甲可知,升高温度醋酸钠的水解程度增大
B. 由图乙可知,a点Kw的数值比b点Kw的数值大
C. 由图丙可知,反应A(g)+B(g) ![]() 2C(g)是吸热反应
2C(g)是吸热反应
D. 由图丁可知,反应C(金刚石,s)= C(石墨,s)的焓变△H=△H1—△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com