
氰酸铵(NH4OCN)与尿素[CO(NH2)2]
A.都是共价化合物 B.都是离子化合物
C.互为同分异构体 D.互为同素异形体
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由Cu、Zn作电极与CuSO4溶液组成的原电池中,Cu是负极
C.马口铁(镀锡铁)破损时与电解质溶液接触,锡先被腐蚀
D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过
查看答案和解析>>
科目:高中化学 来源: 题型:
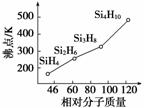
硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是__________________________________________________。
(2)(2012·福建)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:
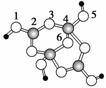
①在Xm-中,硼原子轨道的杂化类型有____________;配位键存在于________原子之间(填原子的数字标号);m=________(填数字)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有________(填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(3)(2012·山东节选)金属镍在电池、合金、催化剂等方面应用广泛。
①过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=________。CO与N2结构相似,CO分子内σ键与π键个数之比为________。
②甲醛(H2C===O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内C原子的杂化方式为________________________________________________________________________,
甲醇分子内的O—C—H键角________(填“大于”“等于”或“小于”)甲醛分子内的O—C—H键角。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是________,写出一种工业制备单质F的离子方程式:__________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为__________,其水溶液与F单质反应的化学方程式为____________________________________________;在产物中加入少量KI,反应后加入CCl4并振荡,有机层显______色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1∶1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为________;b的化学式为______________;c的电子式为________;d的晶体类型是________。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过________键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲~辛等元素在周期表中的相对位置如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断正确的是( )
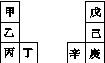
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
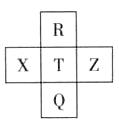 元素R、X、T、Z、Q在元素周期表
元素R、X、T、Z、Q在元素周期表 中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R <T<Q
D.最高价氧化物的水化物的酸性:T>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍。Y、Z分别与钠元素可以形成化合物Q和J ,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。
,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。
请回答下列问题:
⑴M固体的晶体类型是 。
⑵Y基态原子的核外电子排布式是 ① ;G分子中X原子的杂化轨道的类型是 ② 。
⑶L的悬浊液加入Q的溶液,白色沉淀转化为黑色沉淀,其原因是 。
⑷R的一种含氧酸根RO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)原子核外有1个电子 B.1H与D互称同位素
C.H2O与D2O互称同素异形体 D.1H218O与D216O的相对分子质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)
ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)
ΔH2=-1 160 kJ·mol-1
若在标准状况下用CH4还原4.48 L NO2气体至N2,则下列说法中正确的是
A.该过程吸收的热量为86.7 kJ
B.此过程中需要CH4气体1.12 L
C.转移的电子数为0.8NA个
D.已知2NO(g)+O2(g)===2NO2(g) ΔH=-114 kJ·mol-1,则CH4的燃烧热是802 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com