
【题目】下列说法不正确的是( )
A.35Cl和37Cl互为同位素
B.乙酸和油酸(C17H33COOH)互为同系物
C.红磷和白磷互为同素异形体
D.乙醛和环氧乙烷(![]() )互为同分异构体
)互为同分异构体
科目:高中化学 来源: 题型:
【题目】盐酸巴氯芬是一种用于改善骨骼肌痉挛的口服片剂。下面是它的一种合成路线(具体反应条件和部分试剂略):

已知:①RCOOH![]() RCOCl
RCOCl
②H3C-CHO![]() H3C-CH=CH-COOH
H3C-CH=CH-COOH
(1)A是一种芳香烃,其分子式为____,B→C的反应类型为___。
(2)H中所含官能团的名称是______。
(3)写出F→G反应的化学方程式______。
(4)C的同分异构体中能与FeCl3溶液发生显色反应的有____种(不考虑立体异构),其中核磁共振氢谱有3种峰且峰面积之比为2:2:1的结构简式为____。
(5)由B开始制取E的合成路线有多种,请将下列合成路线中的相关内容补充完整,有机物写结构简式,无机物写分子式______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(C7H8)和二甲苯(C8H10)是重要的化工原料。利用苯(C6H6)和甲醇(CH3OH)在催化剂作用下反应得到C7H8、C8H10和副产物三甲苯(C9H12),发生的主要反应如下:
Ⅰ.C6H6(g)+CH3OH(g)C7H8(g)+H2O(g)
Ⅱ.C7H8(g)+CH3OH(g)C8H10(g)+H2O(g)
Ⅲ.C8H10(g)+CH3OH(g)C9H12(g)+H2O(g)
(1)500℃、0.18Mpa条件下,反应达到平衡时,结果如图所示。
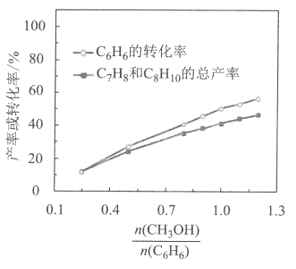
①由图分析,随着投料比![]() 增加,CH3OH的平衡转化率___,平衡时
增加,CH3OH的平衡转化率___,平衡时![]() 的值___。(填“增大”、“减小”或“不变”)
的值___。(填“增大”、“减小”或“不变”)
②投料比![]() 为1.0时,C6H6的平衡转化率为50%,产物中C7H8、C8H10和C9H12物质的量之比为6︰3︰1。CH3OH的平衡转化率为___,反应I的平衡常数K=___。
为1.0时,C6H6的平衡转化率为50%,产物中C7H8、C8H10和C9H12物质的量之比为6︰3︰1。CH3OH的平衡转化率为___,反应I的平衡常数K=___。
(2)我国学者结合实验与计算机模拟结果,研究了反应I在固体酸(HB)催化剂表面进行的反应历程如图所示。其中吸附在固体酸(HB)表面的物种用*标注。
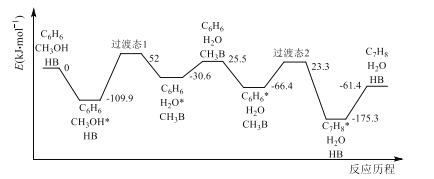
①反应I的H=___kJ·mol-1。
②吸附CH3OH的焓变___吸附C6H6的焓变(填“>”或“<”)。
③C6H6*在催化剂表面转化为C7H8*的反应方程式为___。
④在固体酸(HB)催化作用下,测得反应I的速率方程为v=kp(C6H6)(k为速率常数)。在刚性容器中发生反应I,关于反应I的平衡常数(K)和反应速率(v)的叙述正确的是__(填标号)。
A.升高温度,K和v均增大
B.增大p(C6H6),K不变,v增大
C.降低温度,K和v均减小
D.增大p(CH3OH),K不变,v增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多巴胺是一种重要的中枢神经传导物质,用来帮助细胞传送脉冲的化学物质,能影
响人对事物的欢愉感受。多巴胺可用香兰素与硝基甲烷等为原料按下列路线合成:
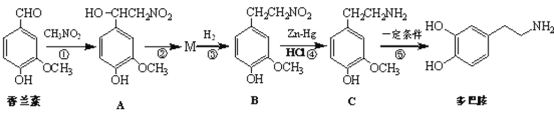
(1)香兰素保存不当往往会导致颜色、气味发生明显变化,其原因是___。
(2)多巴胺中的官能团的名称是___、___,反应①、⑤的反应类型分别为___、___。
(3)写出由A→M的化学方程式___。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:___。
①具有天然氨基酸的共同结构
②能与FeCl3溶液发生显色反应
③有6种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可分为三个阶段:二氧化硫的制取和净化;二氧化硫转化为三氧化硫;三氧化硫的吸收和硫酸的生成。为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为了测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
实验 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L(标准状况) |
1 | 7.24 | 50.00 | 1.792 |
2 | 14.48 | 50.00 | 3.584 |
3 | 21.72 | 50.00 | 4.032 |
4 | 36.20 | 50.00 | 2.240 |
(1)由1组数据直接推测:1.81g样品进行同样实验时,生成氨气的体积(标准状况)为___L。
(2)试计算该混合物中(NH4)2SO4和 NH4HSO4的物质的量之比为___。
(3)求所用NaOH溶液的物质的量浓度___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
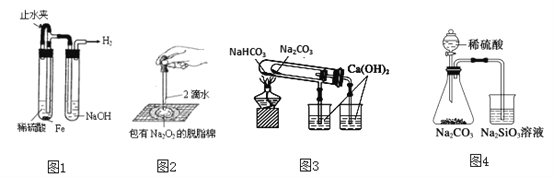
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二次电池装置如图所示,锂、充有催化剂的碳纳米管为电极,电解质能传导Li+。放电时生成的Li2CO3和C附着在电极上,充电时可使Li2CO3转化为Li、CO2和O2。下列说法不正确的是( )
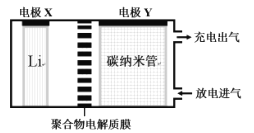
A.放电时,电流从电极Y经外电路流向电极X
B.充电时,电极X接外电源的正极发生氧化反应
C.充电时,电极Y的电极反应式为2Li2CO3-4e-=2CO2↑+O2↑+4Li+
D.应用该电池电镀铜,若析出64gCu,理论上消耗标况下33.6LCO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较给出H+的能力的相对强弱:H2CO3___C6H5OH(填“>”、“<”或“=”);用一个离子方程式说明CO32和C6H5O结合H+能力的相对强弱___。
(2)Ca(CN)2是离子化合物,各原子均满足8电子稳定结构。写出Ca(CN)2的电子式___。
(3)常压下,水晶的硬度比晶体硅的硬度大,其主要原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com