
| A、铁跟稀硫酸反应:Fe+2H+═Fe2++H2↑ |
| B、碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ |
| C、盐酸跟氢氧化钾溶液反应:H++OH-═H2O |
| D、碳酸镁跟硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |


科目:高中化学 来源: 题型:
| A、根据溶液中有CH3COOH、CH3COO-和H+即可证明CH3COOH达到电离平衡状态 |
| B、根据溶液中CH3COO-和H+的物质的量浓度相等即可证明CH3COOH达到电离平衡状态 |
| C、当NH3?H2O达到电离平衡时,溶液中NH3?H2O、NH4+和OH-的浓度相等 |
| D、H2CO3是分步电离的,电离程度依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如图所示.以下有关该物质的说法中正确的是( )
美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如图所示.以下有关该物质的说法中正确的是( )| A、每个该离子中含有35个质子和36个电子 |
| B、该离子中只含有非极性键 |
| C、该离子中含有2个π键 |
| D、N5+与PCl4+互为等电子体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量 | 0.255g | 0.385g | 0.459g |
| 气体体积 | 280mL | 336mL | 336mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、71g Cl2与23g Na充分反应时共转移电子2NA |
| B、标准状况下,NA个分子所占的体积都约是22.4L |
| C、20℃,常压下,48gO3所含的氧原子数为3NA |
| D、1L 0.1mol/L KClO3溶液中所含的Cl-为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热稳定性:H2O>HF>H2S |
| B、酸性:H3PO4>H2SO4>HClO4 |
| C、原子半径:Na>Mg>O |
| D、碱性:NaOH>KOH>Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
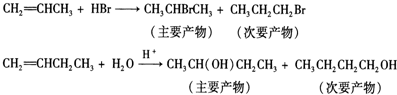
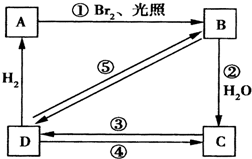
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com