
����Ŀ��ij��ѧ��ȤС��Ϊ��̽��̼�����ϡ���ᷴӦ�����е����ʱ仯����VmLϡ�����м���������̼��ƣ��ռ���Ӧ�ų���CO2����������ѻ���Ϊ��״���µ���ֵ����ʵ���¼���£��ۼ�ֵ����
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
CO2�����mL�� | 50 | 120 | 232 | 290 | 310 |
��1��0��1 min��1��2 min��2��3 min��3��4 min��4��5 min���ʱ����У�_________��Ӧ������졣
��2��������Һ������䣬4��5minʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����Ϊ____________________________��
��3��Ϊ�˽���������ѧ��Ӧ�ķ�Ӧ���ʣ�����Һ�м����������ʣ�����Ϊ���е���
_______________�����ţ���
a������ˮ b��Ũ���� c��NaCl���� d��NaCl��Һ
��4���������������⣬����Ϊ�����Բ�ȡ��Щ��ʩ�����ͻ�ѧ��Ӧ���ʣ�����д������_______________________________________________________________________��
________________________________________________________________________��
���𰸡� 2��3 min 1/560v mol��L-1��min-1 a��d ���ͷ�Ӧ�¶� ���ٽӴ����
���������ɱ������ݿ�֪��0��1��1��2��2��3��3��4��4��5min���������ֱ�Ϊ50mL��70mL��112mL��58mL��20mL��
(1)2 min��3 min�ռ�������������ʱ��ζ࣬��Ӧ���������÷�Ӧ���ȣ��¶����ӿ췴Ӧ�����йأ��ʴ�Ϊ��2��3 min��
(2)��4��5minʱ����ڣ����ɱ���¶�����̼�����Ϊ��20mL��n(CO2)= ![]() =
= ![]() mol����2HCl��CO2��֪��������������ʵ���Ϊ
mol����2HCl��CO2��֪��������������ʵ���Ϊ![]() mol�����(HCl)=
mol�����(HCl)= 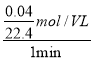 =
=![]() mol/(Lmin)���ʴ�Ϊ��
mol/(Lmin)���ʴ�Ϊ�� ![]() mol/(Lmin)��
mol/(Lmin)��
(3)a����������ˮ�������Ũ�ȼ�С����Ӧ���ʼ�������ȷ��b������Ũ���ᣬ�����Ũ������Ӧ���ʼӿ죬����c������NaCl���壬�����Ũ�Ȳ��䣬��Ӧ���ʲ��䣬����d��NaCl��Һ ���൱��ϡ�����ᣬ�����Ũ�ȼ�С����Ӧ���ʼ�������ȷ����ѡad��
(4)Ҫ����̼��ƺ�����Ļ�ѧ��Ӧ���ʣ����Ը���Ӱ�컯ѧ��Ӧ���ʵ����ؿ��ǣ��罵�ͷ�Ӧ�¶������ٽӴ�����ȣ��ʴ�Ϊ�����ͷ�Ӧ�¶ȡ����ٽӴ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪����2Fe��s��+O2��g��=2 FeO��s����H1=��544.0kJmol��1��
��4Al��s��+3O2��g���T2Al2O3��s����H2=��3351.4kJmol��1��
Al��FeO�������ȷ�Ӧ���Ȼ�ѧ����ʽ��
��2����Ӧ�����������Ϊ��̬��ij���淴Ӧ�ڲ�ͬ�����µķ�Ӧ���̷ֱ�ΪA��B����ͼ��ʾ��
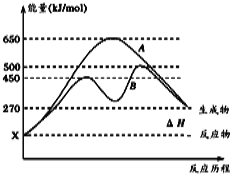
�پ�ͼ�жϸ÷�Ӧ�� ��������š����ȷ�Ӧ������Ӧ�ﵽƽ��������������䣬�����¶ȣ��淴Ӧ���ʽ� �����������С�����䡱����
������B���̱����˷�Ӧ���õ�����Ϊ ������ĸ����
A�������¶� B������Ӧ���Ũ��
C�������¶� D��ʹ�ô���
��3����֪�Ȼ�ѧ����ʽ��2H2��g��+O2��g��=2H2O��g����H=��483.6kJmol��1���÷�Ӧ�Ļ��Ϊ334.4kJmol��1�������淴Ӧ�Ļ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(CeO2)��һ����Ҫ��ϡ�������ƽ�������ʾ�����������в��������ķϲ�����ĩ����SiO2��Fe2O3��CeO2��FeO�����ʣ���ij�������Դ˷�ĩΪԭ�ϣ�������¹������̶���Դ���л��գ��õ�������CeO2��������茶��塣
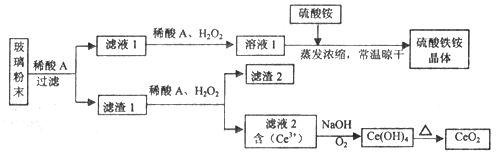
��֪��CeO2������ϡ���ᣬҲ������NaOH��Һ��
(1)ϡ��A�ķ���ʽ��_____________________��
(2)��Һ1�м���H2O2��Һ��Ŀ����__________________��
(3)���ʵ��֤����Һ1�к���Fe2+_____________________��
(4)��֪Fe2+��Һ���Ժ�������ˮ��FeO(OH)��Ӧ����Fe3O4,��д�÷�Ӧ�����ӷ���ʽ____________��
(5)����Һ2����Ce(OH)4�����ӷ���ʽ__________________��
(6)������茶���[Fe2(SO4)3��2(NH4)2SO4��3H2O]�㷺����ˮ�ľ���������������ȥ�����Է�ˮ�е�������ʱЧ�ʽ�������ԭ����___________________��
(7)ȡ���������еõ���Ce(OH)4��Ʒ0.531 g���������ܽ����Ũ��Ϊ0.l000mol��L-1FeSO 4����Һ�ζ����յ�ʱ���汻��ԭΪCe3+ )������25.00 mL����Һ���ò�Ʒ��Ce(OH)4�����÷���Ϊ_______(���������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ���������ʣ��������Ŀ��� ������������Һ ������ˮ ��������Һ���ܹ۲쵽�ж�����������
A. �٢� B. �ڢ� C. �٢� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������г���ƻ�ѧ֪ʶ������˵����ȷ����
A. ��������¥�������ǽ���Ķ����ЧӦ��ɵ�
B. ��������������ˮ�ľ���������
C. ���㽶���з������KMnO4��Һ�Ĺ��������ӳ�������
D. ���ڵⵥ�����������������Գ���ʱ�ӵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F���ֶ�����Ԫ�طֱ�λ���������ڣ����ǵ�ԭ��������������A��Dͬ���壬B��Eͬ���壬C��Fͬ���壬��C��F���γ�ԭ�Ӹ�����Ϊ2��1�Ļ�����M��ԭ�Ӹ�����Ϊ3��1�Ļ�����N����֪F�ĵ���Ϊ����ɫ���壬EԪ���ڵؿ��к����ӵ�2λ��DΪ������
(1)д������Ԫ�ط��ţ�A________��B________��E__________��
(2)����M��D�����������ˮ���ﷴӦ�Ļ�ѧ����ʽ____________________________��
(3)д��F��Ԫ�����ڱ��е�λ��________________��
(4)д��A��C��D�γɵĻ�����ĵ���ʽ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֻ������ͷ�Ӧ��һ������������ԭ��Ӧ���ǣ� ��
A.���ֽⷴӦ
B.�ֽⷴӦ
C.���Ϸ�Ӧ
D.�û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.����������Һ�У���������ˮ�������ɵ�H��Ũ��֮��(�١â�)�� ��
��pH��1������ ��0.01 mol��L��1��NaOH��Һ
II.��֪ˮ��25����95��ʱ�������ƽ��������ͼ��ʾ��
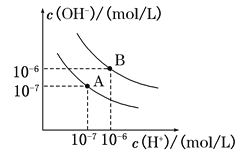
��1����25��ʱˮ�ĵ���ƽ������ӦΪ (�A����B��)��95��ʱˮ�����ӻ�KW= ��
��2��25��ʱ����pH��9��Ba(OH)2��Һ��pH��4��H2SO4��Һ��ϣ������û����Һ��pH��7����Ba(OH)2��Һ��H2SO4��Һ�������Ϊ ��
��3������A��Ӧ�¶��£�pH��2��������Һ��pH��11������������Һ�������1:9��ϣ���Һ��pHԼΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ�������ͨ��A��B��C�������壬����һ���¶ȣ���t1��t4 sʱ��ø����ʵ�Ũ��������������ж���ȷ����( )
�ⶨʱ��/s Ũ�� | t1 | t2 | t3 | t4 |
c(A)/(mol��L��1) | 6 | 3 | 2 | 2 |
c(B)/(mol��L��1) | 5 | 3.5 | 3 | 3 |
c(C)/(mol��L��1) | 1 | 2.5 | 3 | 3 |
A. ��t3 sʱ��Ӧ�Ѿ�ֹͣ
B. t3��t4 s�������淴Ӧ���ʲ����
C. �������з����ķ�ӦΪA(g)��B(g) C(g)
D. ��t2��t3 s��A��ƽ����Ӧ����Ϊ![]() mol/(L��s)
mol/(L��s)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com