
【题目】将氯气通过软管灌入田鼠洞中可用于消灭田鼠,这是利用了Cl2的那些性质
①黄绿色 ②密度比空气大 ③有毒 ④容易液化
A.①② B.②③ C.③④ D.①④
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】能将氯化铁、氯化铵和氯化钠三种溶液区别开的一种试剂是 ( )
A. KSCN溶液 B. BaCl2溶液
C. AgNO3溶液 D. NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当反应条件(如温度、浓度或物质的量等)发生改变时,下列不会引起生成物发生改变的是
A. 钠和氧气 B. 锌和硫酸 C. 氢氧化钠和二氧化碳 D. 氢气和氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:

下列说法正确的是
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B. 反应开始到10s,Y的转化率为79.0%
C. 反应开始到10s,X的物质的量浓度减少了0.79mol/L
D. 反应的化学方程式:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1 000 mL、密度1.192 g·cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________mol·L1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中________L的CO2(标准状况)而变质。(已知:CO2+2NaClO+
H2O![]() Na2CO3+2HClO)
Na2CO3+2HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25%NaClO的消毒液。下列说法正确的是________。
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目:高中化学 来源: 题型:
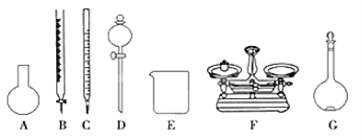
【题目】Ⅰ.实验是化学研究的一种重要手段,现有下图所示A~G七种仪器,请根据要求填空。

(1)写出仪器名称:E_____________,F_____________。
(2)下列实验操作中用到仪器D的是_________(选填下列选项的编号字母 )。
A.分离水和CCl4的混合物 B.分离水和酒精的混合物 C.分离水和泥砂的混合物
Ⅱ.某课外兴趣小组需要200 mL1 mol/L的Na2CO3溶液,请回答下列问题:
(1)配制溶液所需仪器及药品:
应称取Na2CO3的质量 ______(g) | 应选用容量瓶的规格 _______(mL) | 除容量瓶外还需要的其它玻璃仪器是上图中的______、_____及玻璃棒 |
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只能用一次)______________。
A.将已冷却的溶液沿玻璃棒注入容量瓶中
B.用托盘天平准确称量所需Na2CO3的质量,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其溶解(必要时可加热)
C.用适量水洗涤烧杯2~3次,洗涤液均注入容量瓶中,振荡
D.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
E.将容量瓶盖紧,振荡,摇匀
F.继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
(3)若出现如下情况,对所配溶液浓度将有何影响 (填“偏高”、“偏低”或“无影响”)?
没有进行C操作________;配制溶液时,容量瓶未干燥_________;定容时俯视刻度线_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知CuCl2溶液与乙二胺H2N-CH2CH2-NH2[常用(en)表示]作用,可形成配离子(如图所示):

请回答下列问题︰
①乙二胺分子中N原子成键时采取的杂化类型是____________,
乙二胺沸点高于Cl-CH2CH2-Cl的主要原因是___________________________。
②上述配离子中含有的化学键类型有:__________________。(填写代码,多选) ;
a配位键 b极性键 c非极性键 d离子键
③该配合物 [Cu(en)2]Cl2的系统命名为_______;其中铜离子的配位数是_______。
(2)下表中实线是元素周期表的部分边界,其中上边界未用实线标出。

根据信息回答下列问题:
①周期表中基态Ga原子的最外层电子排布式为__________________
②Fe元素位于周期表的_____区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为____;
已知:原子数目和电子总数(或价电子总数)相同的粒子互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为______和______(填化学式)。
③根据VSEPR理论预测ED4-离子的空间构型为_________。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的化学式为____________(写2种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I 、金属镁性质活泼,能与许多物质反应,某校课外活动小组根据镁能在二氧化碳中燃烧,推测Mg也能在NO2燃烧,可能产物为MgO、N2和Mg3N2。通过如图所示实验装置来验证反应产物(夹持装置省略,部分仪器可重复使用)。己知:NO2气体能被NaOH吸收,Mg3N2极易与水反应。
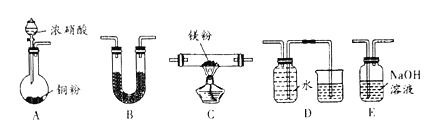
(1)实验中,装置依次连按的顺序为A _________(填字母序号);装置B 的作用是______;
(2)用来检验N2的实验装置为__________(填字母序号);
(3)设计实验证明:产物中存在Mg3N2 ____________;
Ⅱ、工业上以菱镁矿为原料(主要成分为MgCO3,还有SiO2、FeCO3等杂质)制备纳米氧化镁。
(4)根据反应流程要求,先除去FeCO3,采用先酸浸再氧化的方法,其中加入H2O2时,发生反应的离子方程式为__________。
(5)已知:在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,流程后期,当除杂完成后,再加入CO(NH2)2 开始沉淀Mg2+,该过程中发生的两个主要反应为(用化学方程式或离子反应方程式表示)___________;___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com