
【题目】S2Cl2是橙黄色液体,少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法中错误的是( )

A.S2Cl2为非极性分子
B.分子中既含有极性键又含有非极性键
C.与S2Br2结构相似,熔、沸点S2Br2>S2Cl2
D.与水反应的化学方程式可能为2S2Cl2+2H2O===SO2↑+3S↓+4HCl
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)可用于有机合成和药物制造等。实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2[SO2(g)+Cl2(g)![]() SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
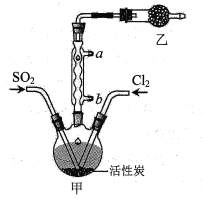
I.SO2Cl2的制备
(1)水应从___(选填“a”或“b”)口进入。
(2)制取SO2的最佳组合是___(填标号)。
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是___。
(4)制备过程中需要将装置甲置于冰水浴中,原因是___。
(5)反应结束后,分离甲中混合物的最佳实验操作是___。
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为___。
(7)产品中SO2Cl2的质量分数为___%,若步骤③不加入硝基苯则所测SO2Cl2含量将___(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 检验蔗糖水解生成葡萄糖 | 取适量蔗糖溶于盛有蒸馏水的试管中,滴入稀硫酸加热一段时间,冷却,滴入新制氢氧化铜悬浊液,加热至沸腾,观察有无砖红色沉淀 |
B | 实验室制备氢氧化铁胶体 | 向盛有25mL蒸馏水的烧杯中滴入5-6滴氯化铁饱和溶液,加热煮沸至溶液呈红褐色,停止加热 |
C | 比较AgCl、AgI的Ksp大小 | 向盛有10滴0.1mol/LAgNO3 溶液的试管中滴加0.1mol/LNaCl溶液至不再有沉淀生成,再滴加0.1mol/lKI溶液 |
D | 比较Mg、Al的金属性强弱 | 用导线连接镁和铝片,插入盛有氢氧化钠溶液的烧杯中,观察气泡 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(1)硫酸工业排出的尾气(主要含SO2)有多种处理方式。
①写出用过量氨水吸收尾气的离子方程式:___________________。
②尾气也可用软锰矿浆(MnO2)吸收,写出如图所示“反应1”的化学方程式:___________________。
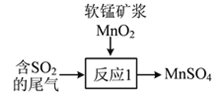
(2)治理汽车尾气中NO和CO的方法之一是在汽车的排气管上装一个催化转化装置,使NO和CO在催化剂作用下转化为无毒物质。写出该反应的化学方程式:___________________。
(3)某工厂拟综合处理含NH废水和工业废气(主要含N2、Cl2、NO),设计了如下流程:

①“反应1”用于吸收Cl2,“反应1”的化学方程式为___________________。
② “反应2”的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要含Fe2O3和SiO2)制备绿矾(FeSO4·7H2O),再通过绿矾制备铁矾[FeO(OH)]的流程如下:(已知FeS2和铁矾均难溶于水)
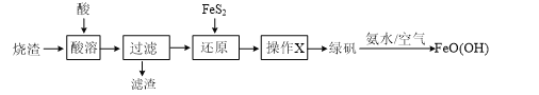
(1)“酸溶”步骤中,最好采用___________________(填“盐酸”、“硫酸”或“硝酸”)溶解烧渣。
(2)写出“还原”步骤发生反应的离子方程式:___________________。
(3)对“还原”后的溶液进行“操作X”,可得到绿矾。“操作X”是指___________________,过滤,洗涤,干燥。
(4)请补充完整检验“还原”后所得溶液中是否含有Fe3+的实验方案:取“还原”后溶液于试管内,___________________。
(5)最后一步制备铁矾的反应中,还生成一种可作化肥的物质,它的化学式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,反应![]() +H2O
+H2O![]() H2CO3+OH的平衡常数K=2.2×108。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
H2CO3+OH的平衡常数K=2.2×108。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
A.0.2mol·L1氨水:c(NH3·H2O)>c(NH4+)>c(OH)>c(H+)
B.0.2mol·L1NH4HCO3溶液(pH>7):c(NH4+)>c(HCO3-)>c(H2CO3)>c(NH3·H2O)
C.0.2mol·L1氨水和0.2mol·L1NH4HCO3溶液等体积混合:c(NH4+)+c(NH3·H2O)=c(H2CO3)+c(HCO3-)+c(CO32-)
D.0.6mol·L1氨水和0.2mol·L1NH4HCO3溶液等体积混合:c(NH3·H2O)+c(CO32-)+c(OH)=0.3mol·L1+c(H2CO3)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图装置进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是
X气体 | Y试剂 | Z试剂 | |
A | NO2 | H2O | H2O |
B | HCl | H2O | H2O |
C | HCl和O2混合气体 | H2O | H2O |
D | NH3和N2混合气体 | H2O | H2O |

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH =-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和1molO2;(乙)1molSO2和0.5molO2;(丙)2molSO3和1molO2。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
2SO3(g) ΔH =-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和1molO2;(乙)1molSO2和0.5molO2;(丙)2molSO3和1molO2。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强P:P丙>P甲=2P乙
B.气体的总物质的量n:n丙>n甲>n乙
C.SO3的体积分数∮:∮甲=∮丙>∮乙
D.反应热量的数值Q:197>Q丙>Q甲>Q乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素,A-E原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素。
(1)E元素在周期表中的位置为__________;B、C的氢化物稳定性强的是________(用化学式表示,下同);B、C、D组成的化合物中含有的化学键为_____________
(2)D2C2的电子式是_________,将D的单质投入A2C中,反应后得到一种无色溶液,E的单质在该无色溶液中反应的离子方程式为______________;
(3)元素D的单质在一定条件下,能与A单质化合生成氢化物DA,熔点为800℃。DA能与水反应放出氢气,化学反应方程式为_____________。
(4)废印刷电路版上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,试写出反应的化学方程式__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com