
【题目】下列说法中正确的是 ( )。
A.将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)→C(金刚石) ΔH=+119kJ·mol·L-1 ”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.31 kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与1mol NaOH溶液混合,放出的热量大于57.3 kJ
D.在101kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH =+285.8 kJ·mol-1
【答案】C
【解析】
A.将等量的硫蒸气和硫固体分别完全燃烧,硫固体转化为硫蒸气吸热,所以后者放出热量少,故A错误;
B.由C(石墨)→C(金刚石)△H=+119kJmolL-1可知,反应是吸热反应,金刚石能量比石墨高,所以石墨比金刚石稳定,故B错误;
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3l kJmol-1,若将含0.5molH2SO4的浓硫酸与lmol NaOH溶液混合,浓硫酸溶于水溶液温度升高,放出的热量大于57.3 kJ,故C正确;
D.2g H2完全燃烧生成液态水,放出285.8 KJ 热量,氢气燃烧的热化学方程式表示为:H2(g)+![]() O2(g)=H2O(l);△H=-285.8 kJmol-1,故D错误;
O2(g)=H2O(l);△H=-285.8 kJmol-1,故D错误;
故选:C。


科目:高中化学 来源: 题型:
【题目】肉桂酸( )主要用于香精香料、食品添加剂、有机合成等方面,它的合成原理为
)主要用于香精香料、食品添加剂、有机合成等方面,它的合成原理为
![]()
 +CH3COOH
+CH3COOH
主要试剂及其物理性质:
名称 | 相对分 子质量 | 性状 | 密度/ (g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解度/(g/100 mL溶剂) | ||
水 | 醇 | 醚 | ||||||
苯甲醛 | 106 | 无色 液体 | 1.044 | -26 | 178~179 | 微溶 | 溶 | 溶 |
乙酸酐 | 102 | 无色 液体 | 1.082 | -73 | 138~140 | 反应 | 溶 | 难溶 |
肉桂酸 | 148 | 白色 粉末 | 1.248 | 133~134 | 300 | 微溶 | 溶 | 溶 |
试剂用量:
试剂名称 | 苯甲醛 | 乙酸酐 | 无水碳酸钾 | 10%氢氧化钠 | 浓盐酸 | 活性炭 |
试剂用量 | 3.0 mL | 5.5 mL | 4~5 g | 40 mL | 25 mL | 1.0 g |
实验仪器如下:

请回答下列问题:
(1)实验准备阶段:在组装实验仪器前要确保反应回流装置彻底干燥,其原因是:_______。
(2)将3.0 mL苯甲醛、5.5 mL乙酸酐和4.00 g无水碳酸钾依次加人250 mL三颈烧瓶中摇匀,烧瓶底部有白色颗粒状固体生成,上部液体无色透明,反应剧烈,有白烟冒出。搭建好回流装置后,开始加热回流。加热回流时控制反应呈微沸状态,加热温度不能太高的原因:_____。
(3)实验结束后,向三颈烧瓶中加人40 mL 10%的氢氧化钠溶液和20 mL的水,可观察到母液体系分为油相和水相。将装置改为水蒸气蒸馏装置,开始加热蒸馏,使油相中的苯甲醛随水蒸气离开母液,开始收集。加人NaOH的作用是:__________。B装置中的长玻璃导管的作用是:_______。水蒸气蒸馏装置中需要加热的仪器有____(填装置序号)。
(4)对蒸气发生器进行加热,待蒸气稳定后再通人烧瓶中的液面下,开始蒸气蒸馏,待检测馏出物中无油滴后停止蒸馏。加人1.0 g活性炭脱色,热过滤。活性炭脱色的原理是______。
(5)加入25 mL的浓盐酸,冰水浴,烧杯中有白色颗粒出现。抽滤(用冰水洗涤),烘箱干燥,称量。称重得m=0.35 g。则该反应的产率约为_____(结果精确至0.1% )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
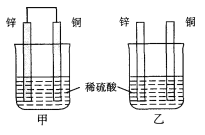
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯溶液中的硫酸浓度均减少
D.甲容器中溶液即使换成酒精也可以形成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) ![]() Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A. 若增大压强,则物质Y的转化率减小
B. 将容器体积变为20 L,Z的平衡浓度变为原来的![]()
C. 以X的浓度变化表示的反应速率为0.001 mol/(L·s)
D. 若升高温度,X的体积分数增大,则该反应的ΔH >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g) ![]() nZ(g) ΔH >0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )
nZ(g) ΔH >0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )
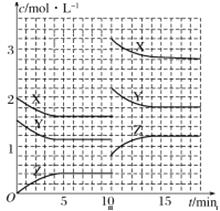
A.反应方程式中n=1
B.10min时,曲线发生变化的原因是升高温度
C.10min时,曲线发生变化的原因是增大压强
D.前5min后,用X表示的反应速率为v(X)=0.08mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。

①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀。最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如下:
AgCl | AgI | Ag2S | |
Ksp | 1.8×10-10 | 8.51×10-16 | 6.3×10-50 |
下列叙述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈(Ce)是镧系金属元素。空气污染物NO通常用含Ce4+的溶液吸收,生成HNO2、NO3ˉ,再利用电解法将上述吸收液中的HNO2转化为无毒物质,同时生成Ce4+,其原理如图所示。下列说法正确的是
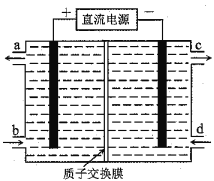
A. H+由右室进入左室
B. Ce4+从电解槽的c口流出,且可循环使用
C. 阴极的电极反应式:2HNO2+6H++6eˉ=N2↑+4H2O
D. 若用甲烷燃料电池作为电源,当消耗标准状况下33.6L甲烷时,理论上可转化HNO22mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是________。欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________。若电解电路中通过2 mol电子,MnO2的理论产量为________。
(4)用间接电化学法除去NO的过程,如下图所示:

已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:_____________。用离子方程式表示吸收池中除去NO的原理:____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com