
【题目】铁、铝是生活中重要的金属材料,铁铝及其化合物有非常重要的用途。
(1)下列说法不正确的是__________(填序号)。
①配制FeCl3、ACl3溶液时,均是先将固体FeCl3、ACl3溶于较浓的盐酸,再用蒸馏水稀释到所需浓度
②FeCl2、FeCl3、Fe(OH)3均可以通过化合反应生成
③利用氯水和KSCN溶液可以检验FeCl3溶液中有无Fe2+
④加热蒸干Al2(SO4)3溶液残留固体的成分为Al2O3
(2)以高碗铝土矿(主要成分为Al2O3、Fe2O3、SiO2、少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

①流程中两次焙烧均会产生SO2,用NaOH溶液吸收处理SO2的离子方程式为___________。
②添加1%CaO和不添加CaO的矿粉焙烧其硫去除率随温度变化曲线如图所示。

已知:多数硫酸盐的分解温度都高于600℃
硫去除率=(1-![]() )×100%
)×100%
I.不添加CaO的矿粉在低于500℃焙烧时,去除的硫元素主要来源于__________。
Ⅱ.700℃时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是___________________。
③“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,写出该反应的化学方程式___________________。
(3)已知25℃时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。
①在25℃下,向浓度均为0.1mo·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成__________(填化学式)沉淀。
②溶液中某离子浓度低于1.0×10-5ml·L-1时,可以认为已沉淀完全。现向一定浓度的AlCl3和FeCl3混合溶液中逐滴加入氨水,当Fe3+恰好沉淀完全时,测得c(Al3+)=0.2mol·L-1,所得沉淀中__________(选填“还含有”或“不含有”)Al(OH)3。理由是___________________(通过计算说明)。
【答案】③④ SO2![]() 2OH-=SO32-
2OH-=SO32-![]() H2O 或SO2
H2O 或SO2![]() OH-=HSO3- FeS2 S转化成了CaSO4,留在矿粉中 FeS
OH-=HSO3- FeS2 S转化成了CaSO4,留在矿粉中 FeS![]() 16Fe2O3
16Fe2O3![]() 11Fe3O4
11Fe3O4![]() 2SO2
2SO2![]() Al(OH)3 不含有 Fe3+完全沉淀时,c(Al3+)·c3(OH-)
Al(OH)3 不含有 Fe3+完全沉淀时,c(Al3+)·c3(OH-)![]() Ksp[Al(OH)3]
Ksp[Al(OH)3]
【解析】
(1)依据实验中所涉及的各物质的性质分析;
(2)①NaOH和SO2反应,生成Na2SO3和H2O或NaHSO3;
②I.由题给已知条件,多数金属硫酸盐的分解温度,高于600![]() ,不添加CaO的矿粉低于 500
,不添加CaO的矿粉低于 500![]() 焙烧时去除的S元素,主要来自于FeS2,Ⅱ.700℃时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是生成了CaSO4;
焙烧时去除的S元素,主要来自于FeS2,Ⅱ.700℃时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是生成了CaSO4;
③Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2;
(3)①物质的溶度积越小,越易形成沉淀;
②根据溶度积常数计算并解答;
(1)①配制FeCl3、AlCl3溶液时,先将固体FeCl3、AlCl3溶于较浓的盐酸,防止Fe3+、Al3+水解,再用蒸馏水稀释到所需浓度,故①正确;
②FeCl2、FeCl3、Fe(OH)3均可以通过化合反应生成,例如:2FeCl3![]() Fe=3FeCl2、2Fe
Fe=3FeCl2、2Fe![]() 3Cl2=3FeCl2、4Fe(OH)2
3Cl2=3FeCl2、4Fe(OH)2![]() O2
O2![]() 2H2O=4Fe(OH)3,故②正确;
2H2O=4Fe(OH)3,故②正确;
③因为Fe3+遇KSCN溶液变成血红色溶液,所以不能用可以氯水和KSCN溶液可以检验FeCl3溶液中有无Fe2+,故③错误;
④加热蒸干Al2(SO4)3溶液虽然Al3水解,但硫酸是难挥发性酸,所以残留固体的成分仍为Al2(SO4)3,故④错误;本题答案为:③④。
(2)①NaOH和SO2反应,生成Na2SO3和H2O,离子方程式为:SO2![]() 2OH-=SO32-
2OH-=SO32-![]() H2O 或SO2
H2O 或SO2![]() OH-=HSO3-;本题答案为:SO2
OH-=HSO3-;本题答案为:SO2![]() 2OH-=SO32-
2OH-=SO32-![]() H2O 或SO2
H2O 或SO2![]() OH-=HSO3-。
OH-=HSO3-。
②I.由题给已知条件,多数金属硫酸盐的分解温度,高于600![]() ,不添加CaO的矿粉低于 500
,不添加CaO的矿粉低于 500![]() 焙烧时去除的S元素,主要来自于FeS2,Ⅱ.700℃时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是生成了CaSO4,留在矿粉中;
焙烧时去除的S元素,主要来自于FeS2,Ⅱ.700℃时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是生成了CaSO4,留在矿粉中;
本题答案为:FeS2,S转化成了CaSO4,留在矿粉中。
③Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,化学方程式为:FeS![]() 16Fe2O3
16Fe2O3![]() 11Fe3O4
11Fe3O4![]() 2SO2;本题答案为:FeS
2SO2;本题答案为:FeS![]() 16Fe2O3
16Fe2O3![]() 11Fe3O4
11Fe3O4![]() 2SO2
2SO2![]() 。
。
(3)①根据Al(OH)3、Cu(OH)2的溶度积常数,在25![]() 下,向浓度均为0.1mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,由于
下,向浓度均为0.1mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,由于![]() ,加入相同的浓度的氨水,Al(OH)3最先析出,本题答案为:Al(OH)3。
,加入相同的浓度的氨水,Al(OH)3最先析出,本题答案为:Al(OH)3。
②Fe3+完全沉淀时,c3(OH-)=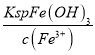 =
=![]() =4.0
=4.0![]() ,c(Al3+)·c(OH-)=0.2
,c(Al3+)·c(OH-)=0.2![]() =8
=8![]() KspAl(OH)3,所以没有生成Al(OH)3沉淀,故此时所得沉淀不含有Al(OH)3;本题答案为;不含有,Fe3+完全沉淀时,c(Al3+)·c3(OH-)
KspAl(OH)3,所以没有生成Al(OH)3沉淀,故此时所得沉淀不含有Al(OH)3;本题答案为;不含有,Fe3+完全沉淀时,c(Al3+)·c3(OH-)![]() Ksp[Al(OH)3]。
Ksp[Al(OH)3]。


科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)△H=+100kJ/mol的能量变化如图所示,判断下列叙述中正确的是
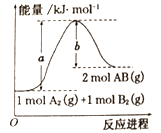
A. 加入催化剂,该反应的反应热△H将减小
B. 每生成2molA-B键,将吸收bkJ能量
C. 每生成2分子AB吸收(a-b)kJ能量
D. 该反应正反应的活化能大于100kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在H3PO4溶液中滴入NaOH溶液,溶液中H3PO4、H2PO4-、HPO42-、PO43-的物质的量分数δ(X),δ(X)随pH的变化如图所示。下列叙述错误的是( )

A.Ka2(H3PO4)的数量级为10-8
B.Kh(HPO42-)=1.0×10-6.8
C.pH=7时c(H2PO4-)>c(HPO42-)
D.NaH2PO4溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的化学用语不正确的是( )
实验 | 解释 | |
A | 25℃0.1mol/L盐酸溶液pH=1 | H2O=H++OH- |
B | 25℃0.1mol/L的NH3·H2OpH=11 | NH3·H2O |
C | 配制FeCl3溶液时加少量盐酸 | Fe3++3H2O |
D | 向0.1mol/LNa2CO3溶液中滴加酚酞试液后溶液变红 | CO32-+H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2 mol·L-1的一元酸HA与等浓度NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A. HA为强酸
B. 该混合溶液pH=7.0
C. 该混合溶液中:c(A-)+c(Y)=c(Na+)
D. 图中X表示HA,Y表示OH-,Z表示H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积为2L的密闭容器内(预先加入催化剂)通入2molNH3,经过一段时间后,测得容器内的压强为起始时的1.2倍.则NH3的转化率为( )
A. 25%B. 80%C. 10%D. 20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)H2S在水中的电离方程式为 。
(1)向H2S溶液中加入浓盐酸时,电离平衡向 (填左、右、不)移动,c(H+) (填增大、减小、不变),c(S2-) (填增大、减小、不变)。
(2)向H2S溶液中加入NaOH固体,电离平衡向 (填左、右、不)移动,c(H+) (填增大、减小、不变),c(S2-) (填增大、减小、不变)。
(3)若要使H2S溶液中c(HS-)增大,且使H2S的电离平衡逆向移动,可以加入 。
(4)向H2S溶液中加水,c(HS-) (填增大、减小、不变),溶液pH (填增大、减小、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应2Mg+CO2![]() 2MgO+C ΔH<0从熵变角度看,可自发进行
2MgO+C ΔH<0从熵变角度看,可自发进行
B.在密闭容器发生可逆反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生
D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7, Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)
A.酸式滴定管未用标准盐酸润洗
B.滴定过程中不慎有液体溅出
C.滴定前仰视读数,滴定后读数正确
D.碱式滴定管未用待测液润洗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com