
物质的量浓度
物质的量浓度的概念:以________里所含溶质B的________来表示溶液组成的物理量,叫做溶质B的物质的量浓度(符号cB).此概念可理解到以下几个层面
(1)公式:由此概念,可统摄出计算cB的公式:cB=![]()
cB=![]()
(2)单位:物质的量浓度单位是物质的量单位与体积单位的合成,有许多,如:mol·mL-1、mol·m-3、kmol·L-1、mmol·L-1、mol·mL-1等,常用单位是mol·L-1.
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源: 题型:
(2)20 mL 1 mol·L-1的NaCl和40 mL 0.5 mol·L-1 CaCl2混合后的溶液中,Cl-的物质的量浓度是_________。
(3)在标准状况下,700 L NH3的物质的量为_________,全部溶解在1 L水中,所得溶液的质量分数为_________,如果该氨水的密度为0.85 g·cm-3,则氨水的体积为_________ L,物质的量浓度为_________。
(4)已知质量分数为37%的浓盐酸的密度为1.19 g·cm-3,该盐酸的物质的量浓度为_________。配制200 mL 0.5 mol·L-1盐酸溶液需要该浓盐酸_________mL。
(5)常温下,相对分子质量为M的某无水盐A的溶解度为S g,则常温时,该盐饱和溶液的质量分数为_________,如果已知该饱和溶液的密度为ρ g·cm-3,则该溶液的物质的量浓度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一容积为4 L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下,发生如下反应:
N2(g)+3H2(g)![]() 2NH3(g ) △H<0 ,
2NH3(g ) △H<0 ,
反应中NH3的物质的量浓度变化情况如右图:
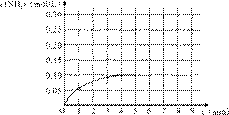
(1)根据上图,计算从反应开始到平衡时,平
均反应速率v(NH3)为______mol/(L·min)。
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为___________。
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d. 0.08 mol/L
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡___________________移动(填“向逆反应方向”、“向正反应方向”或“不”)。
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
(5)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
(A)图Ⅰ可能是不同压强对反应的影响,且P2>P1
(B)图Ⅱ可能是不同压强对反应的影响,且P1>P2
(C)图Ⅲ可能是不同温度对反应的影响,且T1>T2
(D)图Ⅱ可能是同温同压下,催化剂性能对反应的影响,且1>2
查看答案和解析>>
科目:高中化学 来源:2009-2010学年浙江省温州市五校联考高三(上)期末化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com