
【题目】T℃,将2 mol X和1 mol Y充人一体积为1L。的密闭容器中,已知:2X(g)+Y(g) ![]() 2Z(s) △H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是 ( )
2Z(s) △H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是 ( )
A. 在10 min时,X的反应速率为0.02 mol·L-1·min-l
B. 在0~10 min内,Y的反应速率为![]() mol·L-1·min-l
mol·L-1·min-l
C. 增加Z的物质的量加快逆反应速率
D. 反应达平衡后,保持T℃,通入稀有气体增加压强,则化学反应速率变快
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
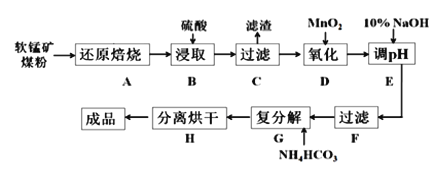
已知:还原焙烧主反应为:2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
根据要求回答下列问题:
(1)步骤B中若采用质量分数为35%的硫酸(密度ρ=1.26 g/cm3),则其物质的量浓度为____。
(2)步骤C中得到的滤渣主要成分是______________________________,步骤D中还原剂与氧化剂的物质的量之比为_____________________________。
(3)步骤E中调节pH的范围为______________________________。
(4)步骤G的离子方程式为_________________________________________,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6 mol/L,则Ksp(MnCO3)=___________。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:____Mn2+ +____ S2O82- + _____H2O = __________________________________,
①请完成上述离子方程式; _____________
②请描述Mn2+未完全反应时出现的现象__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
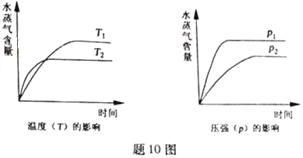
A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 验操作和现象 | 实验结论 |
A | 将FeSO4高温灼烧,产生的气体通入盐酸酸化的BaCl2溶液中,产生白色沉淀 | 气体中含有SO3(g) |
B | 向(NH4)2Fe(SO4)2溶液中,滴入新制氯水,后再滴入KSCN溶液,溶液变红 | 原(NH4)2Fe(SO4)2部分或完全被氧化 |
C | 向两支均盛有2mLKI3溶液的试管中分别滴入淀粉溶液和硝酸酸化的AgNO3溶液,前者溶液变蓝色,后者有黄色沉淀 | 原KI3溶液中存在I3- |
D | 向3mL苯中加入1mL液溴,然后加入少量FeBr3充分反应后,产物倒入水中,烧杯底部有褐色油状液体 | 溴苯呈褐色,不溶于水,密度比水大 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①N2(g)+O2(g)===2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g) ![]() 2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)===2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是

A.反应②中的能量变化如图所示,则ΔH2=E1-E3
B.H2的燃烧热为241.8 kJ·mol-1
C.氨的催化氧化反应为4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH=+906 kJ·mol-1
D.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将2 molSO2和1molO2充入 10 L恒容密闭容器中,发生反应:2SO2(g) +O2(g)![]() 2SO3(g) △H=-196 kJ·mol-1。5 min时达到平衡,测得反应放热166.6kJ。下列说法错误的是( )
2SO3(g) △H=-196 kJ·mol-1。5 min时达到平衡,测得反应放热166.6kJ。下列说法错误的是( )
A. 0~5min内,用O2表示的平均反应速率v(O2)=0.017 mol·L-1·min-1
B. ![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
C. 若增大O2的浓度,SO2的转化率增大
D. 条件不变,若起始时充入4 molSO2和2 molO2,平衡时放出的热量小于333.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.有下列各组物质;
A、O2和O3(臭氧) B、12C和13C C、CH3CH2CH2CH3和CH3CH(CH3)2 D、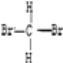 和
和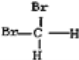
E、葡萄糖和果糖 F、淀粉和纤维素 G、液氯和氯气
(1)______组两物质互为同位素
(2)______组两物质互为同素异形体
(3)______组两组物质互为同分异构体
(4)______组中的物质是同一物质
II、现有下列5种有机物A.苯 B.乙烯 C.乙烷 D.乙醇 E.乙酸。(填代号)
(1)能与H2发生加成反应的有______________。
(2)能与Na反应的有______________________。
(3)能与NaOH溶液反应的有________________。
(4)常温下能与溴水发生化学反应的有________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为
A.1∶1B.2∶1C.2∶3D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,错误的是( )
A.浓硝酸保存在棕色玻璃试剂瓶中
B.少量钠保存在煤油中
C.氢氧化钠溶液保存在带有玻璃塞的玻璃试剂瓶中
D.新制氯水通常保存在棕色试剂瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com