
����Ŀ��ijС����ʵ����ʹ�����̿���Ҫ�ɷ�ΪMnO2����Ũ����ͨ�������Ʊ��������������������ʽ���̽����
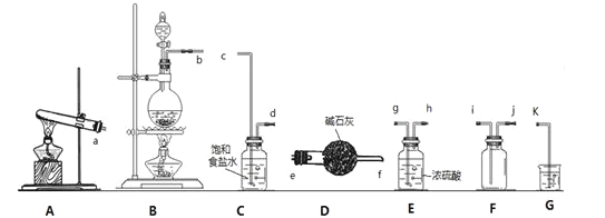
��1��д��ʵ�����������Ļ�ѧ����ʽ��__������ȡ���ռ�һƿ�����������������ȡ���ռ�����ʵ��װ������˳��Ϊ__��c��d��__��i��j��k��
��2��װ��C�б���ʳ��ˮ��������___��
��3����С��ͬѧ���������ʽ�������̽����
ʵ�鲽�� | ʵ����� |
�ٽ�����ͨ��NaCl��Һ�У��ټ���1mLCCl4�����ã��۲����⻯̼����ɫ | �����Դ�ǿ������˳���ȡ��塢�� |
�ڽ�����ͨ��KBr�����У��ټ���1mLCCl4���䣬���ã��۲����Ȼ�̼����ɫ | |
�۽�����ͨ��KI��Һ�У��ټ���1mLCCl4�����ã��۲�������̼����ɫ |
��С���ʵ�����ȱ����___���Ľ��İ취��__��
��4�������£�������ع����Ũ���ᷴӦҲ���Ƶ��������÷�Ӧ�����ӷ���ʽΪ��___��
��5��ij�¶��£���Cl2ͨ��NaOH��Һ�У���Ӧ�õ�NaCl��NaClO��NaClO3�Ļ��Һ�����ⶨClO-��ClO3-��Ũ��֮��Ϊ1��3����Cl2��NaOH��Һ��Ӧʱ����ԭ����Ԫ���뱻��������Ԫ�ص�����֮��Ϊ__��
���𰸡�MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O b g��h ��ȥCl2�е�HCl���� ����֤�����������ǿ�ڵ� ����һ��ʵ�飬����Ϊ��Kl ��Һ�У�������ˮ���ټ���1mLCCl4�����ã��۲�CCl4����ɫ 2KMnO4+16H++10C1-=2K++2Mn2+5Cl2��+8H2O 4��1
MnCl2+Cl2��+2H2O b g��h ��ȥCl2�е�HCl���� ����֤�����������ǿ�ڵ� ����һ��ʵ�飬����Ϊ��Kl ��Һ�У�������ˮ���ټ���1mLCCl4�����ã��۲�CCl4����ɫ 2KMnO4+16H++10C1-=2K++2Mn2+5Cl2��+8H2O 4��1
��������
Ũ����Ͷ������̻�ϼ����������������Ȼ��̺�ˮ���ɵ����غ㡢ԭ���غ㼴��д��������Ӧ�Ļ�ѧ����ʽ��ʵ�����ö������̺�Ũ������ȷ�����ȡ�������Ʊ��������к����Ȼ����ˮ����������ͨ��ʢ�б���ʳ��ˮ��Ũ����ϴ��ƿ��ȥ���ʣ������ܶȴ��ڿ����ܶȣ��������Ŀ������ռ���β��������������Һ���գ��ݴ˷�����
��1�����ö������̺�Ũ�����ϼ�����������������Ӧ�Ļ�ѧ����ʽΪMnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��ʵ�����ö������̺�Ũ������ȷ�����ȡ�������Ʊ��������к����Ȼ����ˮ����������ͨ��ʢ�б���ʳ��ˮ��Ũ����ϴ��ƿ��ȥ���ʣ������ܶȴ��ڿ����ܶȣ��������Ŀ������ռ���β��������������Һ���գ�������ȷ������˳��Ϊ��b��c��d��g��h��i��j��k���ʴ�Ϊ��MnO2+4HCl��Ũ��
MnCl2+Cl2��+2H2O��ʵ�����ö������̺�Ũ������ȷ�����ȡ�������Ʊ��������к����Ȼ����ˮ����������ͨ��ʢ�б���ʳ��ˮ��Ũ����ϴ��ƿ��ȥ���ʣ������ܶȴ��ڿ����ܶȣ��������Ŀ������ռ���β��������������Һ���գ�������ȷ������˳��Ϊ��b��c��d��g��h��i��j��k���ʴ�Ϊ��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��b��g��h��
MnCl2+Cl2��+2H2O��b��g��h��
��2��װ��C�б���ʳ��ˮ�������dz�ȥCl2�е�HCl���ʣ��ʴ�Ϊ����ȥCl2�е�HCl���ʣ�
��3��ʵ��ڵó������������Դ���Br2����ʵ��۵ó������������Դ���I2������ȷ��Br2�������Դ���I2��Ӧ����һ��ʵ�飬����Ϊ��Kl ��Һ�У�������ˮ���ټ���1mLCCl4�����ã��۲�CCl4����ɫ��ȷ��Br2����������I2��������ǿ�����ʴ�Ϊ������֤�����������ǿ�ڵ⣻����һ��ʵ�飬����Ϊ��Kl ��Һ�У�������ˮ���ټ���1mLCCl4�����ã��۲�CCl4����ɫ��
��4�������£����ø�����ع����Ũ���ᷴӦҲ����������������Ӧ�Ļ�ѧ����ʽΪ2KMnO4+16HCl(Ũ)=2MnCl2+5Cl2��+2KCl+8 H2O����÷�Ӧ�����ӷ���ʽΪ2KMnO4+16H++10C1-=2K++2Mn2+5Cl2��+8H2O���ʴ�Ϊ��2KMnO4+16H++10C1-=2K++2Mn2++5Cl2��+8H2O��
��5������ClO-��ClO3-��Ũ��֮��1��3����Cl��ClO-��ʧȥ1�����ӣ���Cl��ClO3-��ʧȥ5�����ӣ�һ��ʧȥ1+3��5=16�����ӣ���Cl��Cl-���õ�1�����ӣ���Ҫ16��ԭ�Ӳ��ܵõ�16�����ӣ����ԣ�����ԭ����Ԫ���뱻��������Ԫ�ص����ʵ���֮��=16����1+3��=4��1���ʴ�Ϊ��4��1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��������CuO��NH3��Ӧ���о�NH3��ij�����ʲ��ⶨ����ɣ����������ʵ��װ�ã��г�װ��δ����������ʵ�顣��ش��������⣺

��1������a������Ϊ______������b�п�ѡ����Լ�Ϊ______��
��2��ʵ�����У�����װ��A��������ȡ����ɫ������______������ĸ����
A��Cl2 B��O2 C��CO2 D��NO2
��3��ʵ���й۲쵽װ��C�к�ɫCuO��ĩ��Ϊ��ɫ���壬����������ɫ��ζ�����壬��������֤��NH3����______�ԣ�д����Ӧ�Ļ�ѧ����ʽ______��
��4��Eװ����Ũ���������______��
��5����ȡ�������ǰ��Ӧ��װ��F���еIJ�����______��
��6��ʵ����ϣ�����ø����D����mg��װ��F�����������Ϊn L��������ɱ�״�����������е������ԭ�Ӹ�����Ϊ______���ú�m��n��ĸ�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ������ȼ�ϵ�ص�ʾ��ͼ����ͼ����ʾ��������������ȷ����(����)

A. a�缫�Ǹ�����b�缫������
B. a�缫�ĵ缫��ӦʽΪH2��2e��===2H��
C. b�缫�ĵ缫��ӦʽΪ4OH����4e��===2H2O��O2��
D. ����ȼ�ϵ�ز���Ҫ����ԭ����������ȫ�������ڵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��M��G��Q�����ֶ���������Ԫ�أ�ԭ��������������X��Z��Q�ĵ����ڳ����¾�����̬��Y��ԭ������������������Ӳ�����2����M��Xͬ�壻Z��G�ֱ��ǵؿ��к�����ߵķǽ���Ԫ�غͽ���Ԫ�ء��ش��������⣺
(1)Y��Z��M��G����Ԫ�ص�ԭ�Ӱ뾶�ɴ�С��˳����____________ (��Ԫ�ط��ű�ʾ)��
(2)Z��Ԫ�����ڱ��е�λ��Ϊ____________��M2Z�ĵ���ʽΪ____________��
(3)����Ԫ�ص�����������Ӧ��ˮ�����У�������ǿ��ˮ������__________(д��ѧʽ)��
(4)X��Y���γɶ��ֻ�������мȺ����Լ��ֺ��Ǽ��Լ��������IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ����____________ (д����)��
(5)GQ3��Һ�������MZX��Һ��Ӧ�Ļ�ѧ����ʽΪ_________________________________
(6)�����£�������G�ĵ��ʷ�����Ӧ����____________ (����)��
a.CuSO4��Һ b.Ũ���� c.NaOH��Һ d.Ũ���� e.����ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ������NH4+��Ũ����Cl-��Ũ�ȱ�Ϊ1��1����Һ������NH4Cl��Һ�м��������� ��
��Ũ���� ��NaCl���� ��Ũ��ˮ �� NaOH����
A. �٢�B. ��C. �ۢ�D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ʽ�У�������ȷ���ﷴӦ��ɫ�仯����
A. ��CuSO4��Һ�м�������Zn�ۣ���Һ��ɫ��ʧZn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. �����ʯ��ˮ���ú���ְ�ɫ����Ca(OH)2+CO2![]() CaCO3��+H2O
CaCO3��+H2O
C. Na2O2�ڿ����з��ú��ɵ���ɫ��Ϊ��ɫ2Na2O2![]() 2Na2O+O2��
2Na2O+O2��
D. ��Mg(OH)2����Һ�еμ�����FeCl3��Һ���ֺ��ɫ����3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������[Sr(ClO3)2]���������ɫ�̻𡣽�����ͨ�����ȵ�����������Һ�Ƶ������ȵ�ʵ��װ�����¡���֪��������[Sr(OH)2]�������ᷴӦ��ˮ�д���Cl��ʱ����Ӱ��HCl���ܽ⣬��������Cl2���ܽ⡣�ش���������

(1)Sr(ClO3)2��ClԪ�صĻ��ϼ���_____��װ��A��Ũ�����ڷ�Ӧ�е�������_____
(2)Y��_____(����ĸ)��������ԭ����_____
A.ŨH2SO4 B.����NaCl��Һ C.NaOH��Һ
(3)װ��D��NaOH��Һ��������_____
(4)װ��C��������ƿ�ڷ����ķ�ӦΪ6Sr(OH)2+6Cl2��Sr(ClO3)2+6H2O+5SrCl2��ת��5mol����ʱ����Sr(ClO3)2��������_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������Ӧ2FeSO4 ![]() Fe2O3+SO2��+SO3��,�������ɵ�����ͨ���Ȼ�����Һ�У��õ��ij�����
Fe2O3+SO2��+SO3��,�������ɵ�����ͨ���Ȼ�����Һ�У��õ��ij�����
A. BaS B. BaSO3 C. BaSO4 D. BaSO3��BaSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CO2��CO��H2��ɵĻ��������ͬ��ͬѹ���뵪�����ܶ���ͬ����û��������CO2��H2��CO������ȿ�Ϊ�� ��
A. 13��8��29B. 22��1��14
C. 29��8��13D. 13��16��57
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com