
������25��ʱ�������ܵ���ʵ��ܽ�ȣ�
| ���ݵ���� | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| �ܽ��/g | 9��10-4 | 1.7��10-6 | 1.5��10-4 | 3.0��10-9 |
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪�������£�A�����ҺpH��a��B�����ҺpH��b��
(1)��AΪ���ᣬBΪ������������a��3��b��11�����ߵ������ϣ���Һ��pHΪ ��
a������7 b������7 c����7
(2)��AΪ���ᣬBΪ�������ƣ���a��4��b��12����ôA��Һ��ˮ�������������Ũ��Ϊ mol/L��B��Һ��ˮ�������������Ũ��Ϊ mol/L��
(3)��A�Ļ�ѧʽΪHR��B�Ļ�ѧʽΪMOH����a��b��14�����ߵ������Ϻ���Һ�Լ��ԡ�������Һ�бض���һ�������ܷ���ˮ�⣬��ˮ�ⷴӦ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�±��Dz�ͬ�¶���ˮ�����ӻ�������
| �¶�/�� | 25 | T1 | T2 |
| ˮ�����ӻ����� | 1��10��14 | a | 1��10��12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������ǿ�ᣬ��ѧ�ν�������ˮ��Һ�п�����ȫ���롣����ʵ�ǣ�������ˮ�еĵ�һ����������ȫ�ģ��ڶ������벢����ȫ����������ΪH2SO4=H����HSO4-��HSO4- H����SO42-��
H����SO42-��
��ش������й����⣺
��1��Na2SO4��Һ��________(������ԡ��������ԡ��������ԡ�)����������__________________________________________��(�����ӷ���ʽ��ʾ)��
��2��H2SO4��Һ��BaCl2��Һ��Ӧ�����ӷ���ʽΪ_________________________��
��3����0.10 mol��L��1��Na2SO4��Һ�У���������Ũ�ȵĹ�ϵ��ȷ����________(��д���)��
| A��c(Na��)��c(SO42-)��c(HSO4-)��c(H2SO4) |
| B��c(OH��)��c(HSO4-)��c(H��) |
| C��c(Na��)��c(H��)��c(OH��)��c(HSO4-)��2c(SO42-) |
| D��c(Na��)��2c(SO42-)��2c(HSO4-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)����������Zn�۷ֱ�Ͷ�룺a��10 mL 0.1 mol��L-1 HCl��
b��10 mL 0.1 mol��L-1������(�����������������)
����Zn����������Ӧ����a b��
����Zn����������H2����a b��
(2)����������Zn�۷ֱ�Ͷ��pH=1�������Ϊ10 mL��a������b��������
����Zn������������ʼ��Ӧ����a b��
����Zn����������H2����a b��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
̼��Ƴ����������Ħ������ijͬѧ�����һ���Ʊ�̼��Ƶķ�����������ͼ���£�������ʯ��ʯ��������SiO2��
�ش��������⣺
��1���������110��ʯ��ʯ�õ�����66�֡���״�������ɶ�����̼�����Ϊ______________L��ʯ��ʯ��̼��Ƶ���������Ϊ______________%��
��2������ڢٲ���Ӧ��ȫ���У���ڢڲ���Ӧ���˺�õ��IJ����������ijɷ�Ϊ________________________��
��3���ڢ۲���Ӧһ�㲻����ͨ��CO2����Ҫԭ����______________________��
��Ӧ�����ӷ���ʽΪ_____________________________________��
��4��CaCO3��һ���������ʣ�25��ʱ��Ksp��2.8��10��9���ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2.0��10��4 mol/L�������ɳ�������CaCl2��Һ�����ʵ���Ũ����С��______________��
��5��ijѧ����ʯ��ʯΪԭ�ϣ��������һ���Ʊ�̼��Ƶ�ʵ�鷽����������ͼ���£�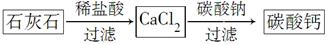
��ǰһ������Ƚϣ��÷������ŵ���_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ش��йصζ������е�������⡣
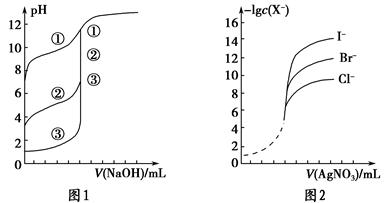
��1������֪Ũ�ȵ�����������Һ�ζ�δ֪Ũ�ȵ����ᣬ�ζ�������ͼ��ʾ��
����ͼ��A��pH��Χʹ�õ�ָʾ����________��
C��pH��Χʹ�õ�ָʾ����________��
�����й��������к͵ζ������еIJ�������ȷ����________������ţ���
| A���ü�ʽ�ζ�����ȡ��֪Ũ�ȵ��ռ���Һ |
| B���ζ��ܺ���ƿ�������ô�װҺ��ϴ |
| C���ζ�������ʼ��ע����ƿ����Һ��ɫ�仯 |
| D����ƿ�еĴ���Һ������Ͳ��ȡ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
Ϊ��֤��������������ʣ��ס��ҡ����������졢���������˷ֱ�ѡ�������Լ�����ʵ�飺
0.10 mol/L������Һ��0.10 mol/L��������Һ��pH=3�����ᡢpH=3�Ĵ��ᡢ�����ƾ��塢�Ȼ��ƾ��塢���ȡ�pH��ֽ������ˮ��
(1)����pH��ֽ���0.10 mol/L�Ĵ�����ҺpH=4�����϶�������������ʣ�����Ϊ��һ������ȷ�� ��(���ȷ������ȷ��)
(2)��ȡ��10 mL 0.10 mol/L�Ĵ�����Һ����pH��ֽ�����pH=a��Ȼ��������ˮϡ�͵�1 000 mL������pH��ֽ�ⶨ��pH=b��Ҫȷ��������������ʣ���a��bӦ������Ĺ�ϵ�� (�õ�ʽ��ʽ��ʾ)��
(3)��ȡ��10 mL 0.10 mol/L������Һ�����������Һ���Ժ�ɫ���ټ�������ƾ��壬��ɫ���ɫ������Ϊ��һ�����ܷ�֤��������������ʣ� ��(��ܡ����ܡ�)
(4)����pH��ֽ���ⶨ0.10 mol/L��������Һ��pH������0.10 mol/L��������Һ��pHΪ9�����϶�������������ʣ�����Ϊ��һ������ȷ�� ��(���ȷ������ȷ��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����������pH=12��NaCN��Һ�У���ˮ�����c(OH��)Ϊ mol?L��1��
��2��Ũ��Ϊ0.1mol?L��1�����и����ʵ���Һ�У�c(NH4+)�ɴ�С��˳����___������ţ���
��NH4Cl ��NH4HSO4 ��NH3?H2O ��CH3COONH4
��3��ij��Ԫ�ᣨ��ѧʽ��H2A��ʾ����ˮ�еĵ��뷽��ʽ�ǣ�
H2A=H+ +HA����HA�� H+ +A2����
H+ +A2����
����Na2A��Һ��____�ԣ�NaHA��Һ�� �ԣ�����ԡ��������ԡ����ԡ�����
������0.1mo1?L��1Na2A����Һ�����и�������Ũ���ɴ�С��˳���ǣ� ������ţ���
| A��c(Na+)>c(A2��)>c(OH��)>c(HA��)>c(H+) |
| B��c(Na+)> c(OH��)>c(HA��)> >c(A2��) > c(H+) |
| C��c(Na+)> c(H+)> c(A2��)> c(OH��)>c(HA��) |
| D��c(A2��)>c(Na+)> c(OH��) > c(H+)>c(HA��) |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com