
【题目】![]() 时,在
时,在![]() 盐酸溶液中逐滴加入
盐酸溶液中逐滴加入![]() 氨水,曲线如图所示,下列说法正确的是
氨水,曲线如图所示,下列说法正确的是
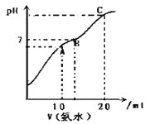
A.此滴定实验可以选用酚酞做指示剂
B.在A点: ![]()
C.在B点: ![]()
D.在C点: ![]()
【答案】D
【解析】
A、根据题意,由图象可知,指示剂不可以选用酚酞,其变色范围是8.2~10.0,应该使用甲基橙,A不符合题意;
B、在A点,氨水量等于盐酸,恰好完全中和生成氯化铵溶液,NH4+会部分水解,c(Cl-)>c(NH4+)>c(H+)>c(OH-),B不符合题意;
C、在B点,氨水量多于盐酸,溶质是NH4Cl和NH3·H2O,溶液呈中性,则溶液中必有c(H+)=c(OH-),根据电荷守恒有c(Cl-)=c(NH4+),氢离子来自水的电离,氢氧根离子来自水的电离和弱碱NH3·H2O的电离,是少量的,而Cl-来自于盐NH4Cl的电离,NH4+大部分来自盐NH4Cl的电离,少部分来自NH3·H2O的电离,Cl-和NH4+是大量的,所以c(Cl-)=c(NH4+) >c(H+)=c(OH-),C不符合题意;
D、在C点形成等浓度的氨水和氯化铵的混合溶液,根据物料守恒:c(NH4+)+c(NH3·H2O) =2c(Cl-),D符合题意;
故选D。


科目:高中化学 来源: 题型:
【题目】在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示,则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为
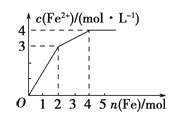
A.3∶1 B.1∶2 C.2∶1 D.1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、M、R为6种短周期元素。W原子的核电荷数等于其周期数,X+与Ne具有相同的电子层结构,Y原子与Z原子的最外层电子数之和与R原子的最外层电子数相等;Y、Z、M、R在周期表中的相对位置如图所示。
Z | M | R | ||
Y |
(1)Z元素在周期表的位置为________。
(2)R离子的结构示意图为_________。
(3)X与M以1:1形成的化合物中存在的化学键类型为____________。
(4)Y的最高价氧化物与X的最高价氧化物的水化物在水溶液中发生反应的离子方程式为_________________________________。
(5)Y与Z 形成相对分子量为144的化合物与M的简单氢化物反应,生成最简单的烃和Y的最高价氧化物的水化物,该反应的化学方程式为__________________________。
(6)M与R可形成M2R2分子,该分子中各原子均达到8电子稳定结构,则M2R2的电子式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。相同状况下,A、B蒸气对氢气的相对密度是97,分子中C、H原子个数相同,且C、H原子个数之和是氧原子数的5倍。已知:各有机物间存在如下转化关系:
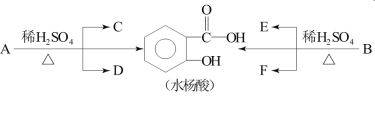
其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类有机物。
(1)A的分子式是________。
(2)E中所含官能团的名称是________;完全燃烧时,1 mol D与1 mol下列________的耗氧量相同(填字母代号)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(3)写出水杨酸与小苏打反应的化学方程式是___________;写出C与F反应的化学方程式是_________。
(4)同时符合下列要求的同分异构体有___________种。
①与A互为同分异构体;
②能发生水解反应;
③苯环上有两个取代基,且苯环上的一氯代物只有1种。
(5)1 mol 上述(4)中的一种有机物X,能与4 mol NaOH发生反应,写出此反应的化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 38.4g 铜与适量浓硝酸恰好反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如下图所示:

下列有关判断正确的是( )
A. 若浓硝酸体积为 200mL,则其物质的量浓度为 11mol/L
B. NO、NO2、N2O4 和 NaOH 溶液反应时, NO2、N2O4 仅作还原剂
C. 生成 0.2 mol NaNO3 和 0.8 mol NaNO2
D. 硝酸在反应中仅体现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种有机化合物的结构简式如下所示,均含有多个官能团,下列有关说法中正确的是( )
①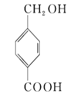 ②
②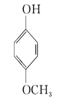 ③
③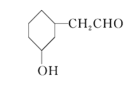 ④
④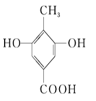
A.①属于酚类,能被O2催化氧化
B.②属于酚类,能使FeCl3溶液显紫色
C.③可以发生消去反应、加成反应、氧化反应
D.1 mol ④能与足量的Na发生反应生成3 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管中在170 ℃下充分反应;
②用水一乙醇液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。消耗标准Na2S2O3溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 2.10 | 2.50 | 1.40 |
滴定后读数/mL | 22.00 | 22.50 | 21.50 |
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________________________________。
(4)气体样品中CO的体积分数为__________(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)
(5)下列操作会造成所测CO的体积分数偏大的是__________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.9g金属锡(Sn)跟100mL12mol·L-1 HNO3共热一段时间。完全反应后测定溶液中c(H+)为8 mol·L-1,溶液体积仍为100mL。产生的气体全部被氢氧化钠溶液吸收,消耗氢氧化钠0.4mol。由此推断氧化产物可能是( )
A.SnO2·4H2OB.Sn(NO3)4
C.Sn(NO3)2D.Sn(NO3)2和Sn(NO3)4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.12.4 g白磷(P4)中所含的P-P键数目为0.6 NA
B.40 g SiC晶体中含有SiC分子的数目为NA个
C.1 mol麦芽糖完全水解后产生的葡萄糖分子数目为NA
D.标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com