
 将Na2CO3和NaHCO3的混合物共19克,加热到质量不再发生变化时,称得剩余固体质量为15.9克.则
将Na2CO3和NaHCO3的混合物共19克,加热到质量不再发生变化时,称得剩余固体质量为15.9克.则
| ||
| 168 |
| m |
| 62 |
| 3.1g |
| 8.4g |
| 84g/mol |
| 0.3mol |
| 1mol/L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、将氯化钠和硝酸钾的混合物用溶解、过滤的方法分离 |
| B、将氢气和氧气的混合气体通过灼热的氧化铜除去氢气 |
| C、用碳酸钠溶液区分氯化钠溶液、氯化钡溶液及硝酸钙溶液 |
| D、将氯化钾和二氧化锰的混合物用溶解、过滤、蒸发的方法分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
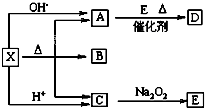 如图是常见物质间的反应关系,其中并且部分产物已被略去.常温下X为固体、B为液态,其余为气体.X受热分解生成A、B、C的物质的量相等.根据图中关系:
如图是常见物质间的反应关系,其中并且部分产物已被略去.常温下X为固体、B为液态,其余为气体.X受热分解生成A、B、C的物质的量相等.根据图中关系:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com