
【题目】将7g某铜银合金与足量的amol/L的HNO3充分反应后,放出的气体与标准状况下的氧气0.56L混合,通入水中恰好完全被吸收,此合金铜的质量是( )
A. 1.6g B. 2.4g C. 3.2g D. 4.8g
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。完成下列填空:

(1)实验时,通常加入过量的乙醇,原因是__________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______;浓硫酸用量又不能过多,原因是_______。
(2)饱和Na2CO3溶液的作用是_______________。
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,______、_______,然后分液。
(4)若用b装置制备乙酸乙酯,其缺点有__________、__________。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.乙烯的产量通常用来衡量一个国家的石油化工水平。以乙烯为主要原料合重要的有机化合物路线如下图所示。请回答下列问题。
![]()
(1)A物质所含官能团的名称是____。
(2)反应③的化学方程式是____。
(3)下列物质中,不能通过乙烯加成反应得到的是____(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
Ⅱ.葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是____。
(2)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是____。
②实验开始时,试管b中的导管不伸入液面下的原因是____。
(3)有机物E由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的E为无色粘稠液体,易溶于水.为研究E的组成与结构,进行了如下实验:
①称取E4.5g,升温使其汽化,测其密度是相同条件下H2的45倍. | ①有机物E的相对分子量为:__. |
②将此9.0gE在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况). | ②9.0g有机物E完全燃烧时,经计算:生成CO2共为____ mol. |
③经红外光谱测定,证实其中含有羟基,羧基,甲基 |
④写出E与NaHCO3溶液反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置可应用于实验室制氯气并回收二氯化锰的实验,能达到实验目的的是
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离出MnCl2溶液中的固体MnO2
D.用装置丁称得回收的二氯化锰质量为5.36 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应的最终产物中,肯定有白色沉淀的是( )
A.向AlCl3溶液中加入过量氨水 B.向Al2(SO4)3溶液中加入过量KOH溶液
C.向澄清石灰水中通入过量CO2 D.向NaAlO2溶液中加入过量稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.80 mol·L-1NaOH溶液480 mL和0.40 mol·L-1硫酸500 mL。根据这两种
溶液的配制情况回答下列问题:
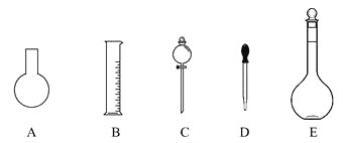
(1)如图所示的仪器中配制溶液肯定不需要的是_____(填字母),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)根据计算用托盘天平称取NaOH的质量为__g,应放在_________(填仪器名称)称量。
(3)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为
______mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL的量筒,应选用____mL的量筒最好。
(4)下列操作会引起所配溶液浓度偏大的是____(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.向容量瓶中转移时,有少量液体溅出
C.定容时仰视刻度线
D.定容后倒置摇匀后再正立时,发现液面低于刻度线
(5)温度计、量筒、滴定管的一部分如图所示,下述读数 (虚线所指刻度)及说法正确的是____(填字母)。
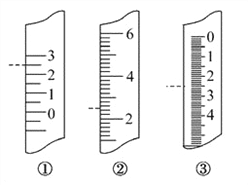
A.①是量筒,读数为2.5 mL B.②是量筒,读数为2.5 mL
C.③是滴定管,读数为2.5 mL D.①是温度计,读数为2.5℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关,下列说法正确的是( )
A. 加热能杀死流感病毒是因为蛋白质受热变性
B. 用乙醚从黄花蒿中提取青蒿素是利用了氧化还原反应原理
C. “丹砂(HgS)烧之成水银,积变又成丹砂。”这个过程是可逆反应
D. 丁达尔效应可用于区别溶液与胶体,云、雾、稀硫酸均能产生丁达尔效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com