
【题目】实验室需要0.80 mol·L-1NaOH溶液480 mL和0.40 mol·L-1硫酸500 mL。根据这两种
溶液的配制情况回答下列问题:
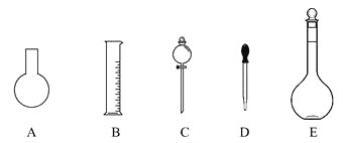
(1)如图所示的仪器中配制溶液肯定不需要的是_____(填字母),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)根据计算用托盘天平称取NaOH的质量为__g,应放在_________(填仪器名称)称量。
(3)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为
______mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL的量筒,应选用____mL的量筒最好。
(4)下列操作会引起所配溶液浓度偏大的是____(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.向容量瓶中转移时,有少量液体溅出
C.定容时仰视刻度线
D.定容后倒置摇匀后再正立时,发现液面低于刻度线
(5)温度计、量筒、滴定管的一部分如图所示,下述读数 (虚线所指刻度)及说法正确的是____(填字母)。
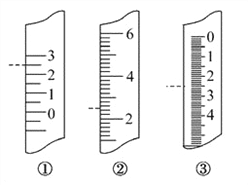
A.①是量筒,读数为2.5 mL B.②是量筒,读数为2.5 mL
C.③是滴定管,读数为2.5 mL D.①是温度计,读数为2.5℃
【答案】 A C 500mL容量瓶和玻璃棒 16.0 小烧杯 10.9 15 A BD
【解析】(1)配制一定物质的量浓度的溶液,步骤有:计算、称量、溶解、冷却转移、洗涤转移、定容、摇匀。肯定不需要烧瓶和分液漏斗,配制上述溶液还需用到的玻璃仪器有500mL容量瓶和玻璃棒,故答案为:AC;500mL容量瓶和玻璃棒;
(2)NaOH的质量为0.5L×0.8mol/L×40g/mol=16.0g,氢氧化钠具有腐蚀性,应该用小烧杯称量,故答案为:16.0;小烧杯;
(3)质量分数为98%、密度为1.84 g·cm-3的浓硫酸的物质的量浓度c=![]() =
=![]() =18.4mol/L,体积为
=18.4mol/L,体积为![]() =0.0109L=10.9mL,可以选用15 mL的量筒量取,故答案为:10.9;15;
=0.0109L=10.9mL,可以选用15 mL的量筒量取,故答案为:10.9;15;
(4)A.用量筒量取浓硫酸时,仰视量筒的刻度,单质量取的浓硫酸体积偏大,则浓度偏大,正确;B.向容量瓶中转移时,有少量液体溅出,导致溶质的物质的量偏小,浓度偏小,错误;C.定容时仰视刻度线,导致溶液的体积偏大,浓度偏小,错误;D.定容后倒置摇匀后再正立时,发现液面低于刻度线,对结果无影响,错误;故选A;
(5)A.量筒没有0刻度,故A错误;B.②是量筒,读数为2.5 mL,故B正确;C.滴定管的0刻度在上端,③是滴定管,读数为2.50 mL,故C错误;D.温度计的0刻度在中间,①是温度计,读数为2.5℃,故D正确;故选BD。


科目:高中化学 来源: 题型:
【题目】如右图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为 , K+移向 极(填A、B)

(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:①A电极附近可观察到的现象是 。
②B电极上的电极反应式为 ,总反应化学方程式是 。
③反应一段时间后打开K2 , 若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL, 将溶液充分混合,溶液的pH约为 。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 。
(3)如要用电解方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 ,电极反应式是 ,反应一段时间后电解质溶液中Cu2+浓度 (填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将7g某铜银合金与足量的amol/L的HNO3充分反应后,放出的气体与标准状况下的氧气0.56L混合,通入水中恰好完全被吸收,此合金铜的质量是( )
A. 1.6g B. 2.4g C. 3.2g D. 4.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少大气污染,许多城市推广汽车使用清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(IPG)。这两类燃料的主要成分都是( )
A. 碳水化合物 B. 碳氢化合物 C. 氢气 D. 醇类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德,以下是其中检测出的两种兴奋剂的结构:(注:苯环上的卤原子不易水解,但在一定条件下遇碱液也能缓慢水解)

关于它们的说法中正确的是
A. Y遇到氯化铁溶液时显紫色,并能发生加成、消去、水解等反应
B. 1个Y分子中最多有8个碳原子共面
C. 1molX与足量氢气反应,最多可消耗6molH2
D. 在一定条件下, 1mol X与足量NaOH溶液反应,最多消耗5mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,下图中曲线X、Y、Z是在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线。由图中数据分析:
① 该反应的化学方程式为__________________________;
② 反应开始至2s,Z的平均反应速率为______________。

Ⅱ.①根据下列图示,写出反应的热化学方程式:___________________________________。

②已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是: ___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A. Fe比Cu活泼,FeCl3溶液可用作铜制线路板的蚀刻剂
B. SiO2熔点高,可用作半导体材料
C. Ca(C1O)2具有氧化性,可用于消菌杀毒
D. CO2密度比空气大,可用作镁着火时的灭火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L 的恒容密闭容器中发生如下反应:A(g)B(g)+C(g) ΔH>0。
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | 达到平衡所需时间(s) | |
A(g) | B(g) | C(g) | |||
Ⅰ | T1 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | T2 | 0.80 | t2 | ||
Ⅲ | T3 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是
A. 达到平衡的时间:t3>t1
B. 反应达到平衡时,A的转化率:容器Ⅱ>容器I
C. 反应达到平衡时,容器I中的平均速率为v(A)=(0.10/t1)mol/(L·s)
D. T1时,该反应的平衡常数为1/60mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com