
【题目】(1)3.6gH2O的物质的量是_______mol,含有_________ 个H2O。
(2)标准状况下,11.2L的H2S气体质量为17g,则H2S的摩尔质量是_________;等物质的量的NH3与H2S质量比为___________,1.7g氨气与________mol H2O含有的电子数相等。
【答案】0.20.2NA或1.204×102334g/mol1:20.1
【解析】
(1)水的相对分子质量是18,所以.3.6g H2O的物质的量是![]() =0.2mol。根据可知,水分子数是0.2NA;
=0.2mol。根据可知,水分子数是0.2NA;
(2)标准状况下,11.2L的H2S的物质的量为n=![]() =
=![]() =0.5mol,而质量为17g,则:M(H2S)=
=0.5mol,而质量为17g,则:M(H2S)=![]() =
=![]() =34g/mol;根据n=
=34g/mol;根据n=![]() 可知,等物质的量的NH3与H2S质量比等于相对分子质量之比,即17:34=1:2;1.7g氨气的物质的量为:
可知,等物质的量的NH3与H2S质量比等于相对分子质量之比,即17:34=1:2;1.7g氨气的物质的量为:![]() =0.1mol,含电子的物质的量为:0.1mol×(7+3×1)=1mol,则水含有的电子的物质的量也为1mol,一个水分子含有的电子数为(2×1+8)=10,所以水的物质的量为
=0.1mol,含电子的物质的量为:0.1mol×(7+3×1)=1mol,则水含有的电子的物质的量也为1mol,一个水分子含有的电子数为(2×1+8)=10,所以水的物质的量为![]() =0.1mol。
=0.1mol。


科目:高中化学 来源: 题型:
【题目】某化学实验室需要0.2 mol·L-1的NaOH溶液450 mL和0.5 mol·L-1的硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是__(填序号),配制上述溶液还需用到的玻璃仪器是__________(填仪器名称)。

(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的 ____(填写序号)。
①温度 ②浓度 ③容量 ④压强 ⑤酸式或碱式 ⑥刻度线
(3)配制时,其正确的操作顺序是____(用字母表示,每个字母只能用一次)。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算好的氢氧化钠固体于烧杯中,再加入少量水(约50 mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C.将容量瓶盖紧,摇匀
D.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
(4)根据计算可知,该实验需称取NaOH固体的质量为_______________g。
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是___________________。
(6)将所配制的稀H2SO4进行测定,发现实际浓度小于0.5 mol·L-1。请你分析下列哪些操作会引起所配浓度偏小_________________(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.往容量瓶转移时,有少量液体溅出
D.在容量瓶中定容时俯视容量瓶刻度线
E.烧杯未进行洗涤
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制氢气时,下列措施不能使反应速率加快的是( )
A.加热
B.不用稀硫酸,改用98%的浓硫酸
C.滴加少量CuSO4溶液
D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂和蛋白质是维持人体生命活动的三大营养物质。下列有关说法正确的是 ( )
A.三大营养物质均属于天然高分子化合物
B.食用的蛋白质、糖和油脂都可发生水解反应
C.用于纺织的棉花和蚕丝的主要成分都是纤维素
D.75%酒精可用于杀死新型冠状病毒是因为酒精使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知723 K时,2SO2(g)+O2(g)![]() 2SO3(g)ΔH=﹣QkJ·
2SO3(g)ΔH=﹣QkJ·![]() ,在相同条件下,向一密闭容器中通入2mol SO2和1 mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ.则Q1、Q2、Q满足的关系是( )
,在相同条件下,向一密闭容器中通入2mol SO2和1 mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ.则Q1、Q2、Q满足的关系是( )
A. Q2=![]() B. Q2>
B. Q2>![]() C. Q2<Q1<Q D. Q=Q1>Q2
C. Q2<Q1<Q D. Q=Q1>Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是( )
A.过滤时,不可将悬浊液从烧杯中直接倒入漏斗中
B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C.分液操作时,现将分液漏斗中下层液体从下口放出,再将上层液体从下口放出
D.只要是液体混合物就可以用蒸馏来分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手持技术的氧电化学传感器可用于测定O2含量.下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为a L(标准准状况),某电极增重了bg。下列说法正确的是
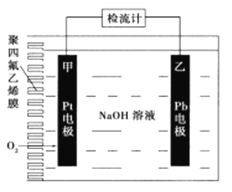
A. Pt上发生氧化反应 B. Pb上的电极反应式为4OH--4e-=O2↑+2H2O
C. 反应过程中转移OH-的物质的量为0.25bmol D. 待测气体中氧气的体积分数为0.7b/a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态铜原子的电子排布式为______;价电子中成对电子数有____个。
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3分子中的中心原子的杂化方式是_________。
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3___H3PO4(填“>”或“<”),从结构的角度说明理由:__________________________。
(3)磷青铜中的锡、磷两元素电负性的大小为Sn___P(填“>”“<”或“=”)。
(4)某磷青铜晶胞结构如图所示。
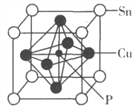
①则其化学式为________。
②该晶体中距离Cu原子最近的Sn原子有______个,这些Sn原子所呈现的构型为_________。
③若晶体密度为8.82g·cm-3,最近的Cu原子核间距为____pm(用含NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com