
【题目】镁、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)铜元素位于元素周期表中的___区,其基态原子的价电子排布图为_________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是_______。
②在[Cu(NH3)4]SO4中,配离子所含有的化学键为________,提供孤电子对的成键原子是_______。
③ 除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为_______。
④NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为_____。但NF3不易与Cu2+形成化学键,其原因是____________。
(3)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为________,若该晶胞的参数为dnm,则该合金的密度为____ g/cm3(不必化简,用NA表示阿伏加德罗常数)。
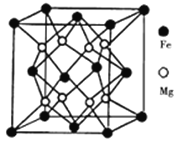
【答案】 ds ![]() 正四面体 共价键、配位键 N Cu<H<N<O sp3 F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子 Mg2Fe 【答题空10】
正四面体 共价键、配位键 N Cu<H<N<O sp3 F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子 Mg2Fe 【答题空10】![]()
【解析】(1)Cu是29号元素,原子核外电子数为29,位于元素周期表中的ds区。Cu基态原子核外电子排布式为:1s22s22p63s23p63d104s1,价电子排布式为:3d104s1,价电子排布图为:![]() 。故答案为:ds;
。故答案为:ds;![]() ;
;
(2)①SO42-中S原子的孤对电子对数=![]() ,价层电子对数=4+0=4,离子空间构型为正四面体。故答案为:正四面体;
,价层电子对数=4+0=4,离子空间构型为正四面体。故答案为:正四面体;
②Cu2+提供空轨道,NH3中N原子含有孤电子对,二者之间形成配位键,NH3中N与H形成共价键,故答案为:共价键、配位键;N;
③非金属性越强,电负性越大,同周期主族元素从左至右电负性增强,故电负性H<N<O,Cu为金属元素,吸引电子的能力非常弱,故电负性最弱。故电负性大小顺序为:Cu<H<N<O。故答案为:Cu<H<N<O;
④NH3中N原子杂化轨道数为(5+3)÷2=4,采取sp3杂化方式;F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子。故答案为:sp3;H的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子。
(3)晶体是由无数晶胞无隙并置而成。根据均摊原则晶胞中铁原子数![]() =4,镁原子数8,,铁镁合金的化学式是Mg2Fe,设有1mol晶胞,体积为
=4,镁原子数8,,铁镁合金的化学式是Mg2Fe,设有1mol晶胞,体积为![]() ,质量为104
,质量为104![]() ,根据
,根据![]() 可知合金的密度是:
可知合金的密度是: ![]() 。答案为:Mg2Fe、
。答案为:Mg2Fe、![]()


科目:高中化学 来源: 题型:
【题目】下列事实不能体现乙酸酸性的是( )
A.乙酸滴入碳酸钠溶液中会出现气泡
B.乙酸中滴加几滴石蕊溶液呈红色
C.乙酸和水能以任意比例互溶
D.长时间使用的热水瓶胆可以用乙酸来洗去水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择下列实验方法分离物质,将分离方法的序号填在横线上. A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
(1)分离粗盐中混有的泥沙 .
(2)分离碘和水的混合物 .
(3)分离水和汽油的混合物
(4)分离酒精和水的混合物 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示。据图判断正确的是
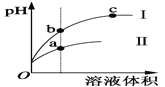
A. Ⅱ为盐酸稀释时pH变化曲线
B. b点溶液的导电性比c点溶液的导电性弱
C. a点KW的值比c点KW的值大
D. 与相同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积,a点比b点大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法中正确的是
A.同一主族元素的原子序数的差不可能为10
B.同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1
C.催化剂一般在金属与非金属的分界线处寻找
D.过渡元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.液氨可用作制冷剂B.SO2使湿润的蓝色石蕊试纸变红
C.常温下可以用铁或铝制容器盛装浓硝酸或浓硫酸D.测定某雨水的pH值小于7.0可判断雨水为酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1NaOH 溶液分别滴定20.00mL 浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如右图。下列说法正确的是

A. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
C. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com