
【题目】常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子的浓度变化如图所示(第一次平衡时c(I-)=2×10-3mol·L-1,c(Pb2+)=1×10-3mol·L-1),下列说法不正确的是

A.常温下,PbI2的Ksp=4×10-9
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度减小,Pb2+浓度不变
C.T时刻可能向溶液中加入了KI固体,Ksp不变
D.常温下Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
【答案】B
【解析】
A. 常温下,PbI2的Ksp=c(Pb2+)×c2(I-) = 1×103×(2×103)2 = 4×109,故A正确;
B. 温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,c(Pb2+)增大,溶解平衡逆向移动,因此PbI2的溶解度减小,Pb2+浓度增大,故B错误;
C. T时刻,c(I-)突然增大,c(Pb2+)瞬间不变、后减小,可能向溶液中加入了KI固体,Ksp不变,故C正确;
D. 常温下Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)反应的化学平衡常数
PbS(s)+2I-(aq)反应的化学平衡常数 ,故D正确;
,故D正确;
综上所述,答案为B。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,11.2 L四氯化碳中含有的分子数0.5NA
B.常温常压下,18.0 g水所含的电子数为10 NA
C.300mL 0.1mol/L的NaCl的溶液含有0.03NA个NaCl分子
D.1.2 g熔融的NaHSO4含有阴阳离子总数为0.03NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四只盛有不同溶液的烧杯中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):

则下列分析都正确的组合是( )
①I图对应溶液中的溶质为NaHCO3
②II图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1:1
③III图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1:1
④IV图对应溶液中的溶质为Na2CO3
A.①② B.①③ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)原子序数大于4的主族元素A和B的离子Am+和Bn-它们的核外电子排布相同,据此推断:
①A和B所属周期数之差为___________
②A和B的核电荷数之差为____________(用含m、n的代数式表示)
③B和A的族序数之差为______________(用含m、n的代数式表示)
(2)A、B两元素,A的原子序数为x,A和B所在周期包含元素种类数目分别为m和n。回答下列问题:
①如果A和B同在ⅠA族,当B在A的上一周期时,B的原子序数为_____________;当B在A的下一周期时,B的原子序数为______________;
②如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为___________当B在A的下一周期时,B的原子序数为______________。
(3)某粒子的结构示意图为: 试回答:
试回答:
①当x-y=10时,该粒子为________(填“原子”或“阳离子”“阴离子”)
②当y=8时,该粒子可能是(写名称):_______、________、_______、_______、_______。
③写出y=3与y=7的元素最高价氧化物对应水化物发生反应的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
(1)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
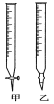
(2)本实验滴定达到终点的标志是___________________。
(3)通过上述数据,求得x=________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是25℃时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | 1.8×10-10 | 2.0×10-12 | 1.8×10-5 | 3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水的离子方程式H2O+CO32-+Cl2=HCO3-+Cl-+HClO
C.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COO-):c(CH3COOH)=9:5,此时溶液pH=5
D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3,CrO42-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关滴定的说法正确的是( )
A. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
B. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中有NaOH杂质,则结果偏低
C. 用C1mol/L酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点用去酸性高猛酸钾溶液体积为V1mL,则H2C2O4溶液的浓度为![]() mol/L
mol/L
D. 用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近雾霾天气肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,Na2SO3溶液呈碱性的原因是_____。(用离子方程式表示)
(2)已知H2SO3的电离常数为K1=1.5×10-2,K2=1.0×10-7;H2CO3的电离常数为K1=4.3×10-7,K2=5.6×10-11;则下列微粒可以大量共存的是_____(填序号)。
A.CO32-和HSO3- B.HCO3-和HSO3- C.H2SO3和HCO3- D.SO32-和HCO3-
(3)根据上述信息,当溶液的pH=5时,溶液中![]() =_________(填具体数值)。
=_________(填具体数值)。
(4)吸收液吸收SO2的过程中,水溶液中H2SO3、HSO3-、SO32-随pH的分布如图:

①吸收SO2制备NaHSO3溶液,实验中确定何时停止通SO2的实验操作为_________。
②在0.1mol·L1NaHSO3溶液中离子浓度关系不正确的是_________(填序号)。
A.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) B.c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)
C.c(H2SO3)+c(H+)=c(SO32-)+c(OH-) D.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(5)亚硫酰氯(SOCl2)又名氯化亚砜,是一种液态的非电解质,沸点为77℃。SOCl2中氯元素与硫元素直接以共价键相连,其中Cl呈1价;SOCl2遇水可生成SO2。请回答下列问题:蒸干MgCl2溶液不能得到无水MgCl2,若将SOCl2与MgCl2·6H2O混合并加热,可制得无水MgCl2,请用SOCl2与水反应的方程式和必要的文字描述解释原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,密闭容器中发生![]() △H=-a kJ·mol-1(a>0),反应过程中速率随时间的变化如图所示,下列说法不正确的是
△H=-a kJ·mol-1(a>0),反应过程中速率随时间的变化如图所示,下列说法不正确的是

A.t1时刻X的正反应速率等于Z的正反应速率
B.t2时刻可逆反应达到平衡状态
C.t2时刻以后,平均反应速率为0,说明反应不再发生
D.0~t2时间内反应放出的热量可能是akJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com