
【题目】最近雾霾天气肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,Na2SO3溶液呈碱性的原因是_____。(用离子方程式表示)
(2)已知H2SO3的电离常数为K1=1.5×10-2,K2=1.0×10-7;H2CO3的电离常数为K1=4.3×10-7,K2=5.6×10-11;则下列微粒可以大量共存的是_____(填序号)。
A.CO32-和HSO3- B.HCO3-和HSO3- C.H2SO3和HCO3- D.SO32-和HCO3-
(3)根据上述信息,当溶液的pH=5时,溶液中![]() =_________(填具体数值)。
=_________(填具体数值)。
(4)吸收液吸收SO2的过程中,水溶液中H2SO3、HSO3-、SO32-随pH的分布如图:

①吸收SO2制备NaHSO3溶液,实验中确定何时停止通SO2的实验操作为_________。
②在0.1mol·L1NaHSO3溶液中离子浓度关系不正确的是_________(填序号)。
A.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) B.c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)
C.c(H2SO3)+c(H+)=c(SO32-)+c(OH-) D.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(5)亚硫酰氯(SOCl2)又名氯化亚砜,是一种液态的非电解质,沸点为77℃。SOCl2中氯元素与硫元素直接以共价键相连,其中Cl呈1价;SOCl2遇水可生成SO2。请回答下列问题:蒸干MgCl2溶液不能得到无水MgCl2,若将SOCl2与MgCl2·6H2O混合并加热,可制得无水MgCl2,请用SOCl2与水反应的方程式和必要的文字描述解释原因_________。
【答案】SO32-H2OHSO3-OH- BD 15 测量溶液的pH,若pH约为4,停止通SO2 D SOCl2+H2O=SO2+2HCl,随着SOCl2的通入,能够消耗MgCl2·6H2O分解产生的水,同时生成的HCl抑制了MgCl2的水解
【解析】
(1)钠碱循环法中,Na2SO3溶液呈碱性是亚硫酸根水解。
(2)根据电离平衡常数得出酸性强弱为H2SO3>H2CO3>HSO3->HCO3-,因此A. CO32-和HSO3-反应生成HCO3-和SO32-,不能大量共存;B. HCO3-和HSO3-共存;C. H2SO3和HCO3-反应生成二氧化碳、水和HSO3-,不能大量共存;D. SO32-和HCO3-共存。
(3)当溶液的pH=5时,根据溶液中![]() 计算。
计算。
(4)①吸收SO2制备NaHSO3溶液,根据题中图像信息HSO3-大量存在时的pH为4左右;②A. 根据物料守恒得出c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3);B. NaHSO3溶液中,HSO3-的电离程度大于水解程度,溶液显酸性,因此有c(Na+)>c(HSO3-) >c(SO32-) >c(OH-);C. NaHSO3溶液中的质子守恒c(H2SO3)+c(H+)=c(SO32-)+c(OH-);D. 根据电荷守恒得到c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)。
(5)SOCl2与水反应生成HCl和SO2即SOCl2+H2O=SO2+2HCl,随着SOCl2的通入,能够消耗MgCl2·6H2O分解产生的水,同时生成的HCl抑制了MgCl2的水解。
(1)钠碱循环法中,Na2SO3溶液呈碱性是亚硫酸根水解,其离子方程式表示原因是SO32-H2OHSO3-OH-;故答案为:SO32-H2OHSO3-OH-。
(2)已知H2SO3的电离常数为K1=1.5×10-2,K2=1.0×10-7;H2CO3的电离常数为K1=4.3×10-7,K2=5.6×10-11,则酸性强弱顺序为H2SO3>H2CO3>HSO3->HCO3-,
A. CO32-和HSO3-反应生成HCO3-和SO32-,不能大量共存,故A不符合题意;
B. HCO3-和HSO3-共存,故B符合题意;
C. H2SO3和HCO3-反应生成二氧化碳、水和HSO3-,不能大量共存,故C不符合题意;
D. SO32-和HCO3-共存,故D符合题意;
因此微粒可以大量共存的是BD;故答案为:BD。
(3)根据上述信息,当溶液的pH=5时,溶液中![]() ;故答案为:15。
;故答案为:15。
(4)①吸收SO2制备NaHSO3溶液,根据题中图像信息HSO3-大量存在时的pH为4左右,因此实验中确定何时停止通SO2的实验操作为测量溶液的pH,若pH约为4,停止通SO2;故答案为:测量溶液的pH,若pH约为4,停止通SO2。
②A. 根据物料守恒得出c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),故A正确;
B. NaHSO3溶液中,/span>HSO3-的电离程度大于水解程度,溶液显酸性,因此有c(Na+)>c(HSO3-) >c(SO32-) >c(OH),故B正确;
C. NaHSO3溶液中的质子守恒为c(H2SO3)+c(H+)=c(SO32-)+c(OH-),故C正确;
D. 根据电荷守恒得到c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故D错误;
综上所述,答案为D。
(5)蒸干MgCl2溶液不能得到无水MgCl2,若将SOCl2与MgCl2·6H2O混合并加热,可制得无水MgCl2,根据题意知SOCl2与水反应生成HCl和SO2即SOCl2+H2O=SO2+2HCl,随着SOCl2的通入,能够消耗MgCl2·6H2O分解产生的水,同时生成的HCl抑制了MgCl2的水解;故答案为:SOCl2+H2O=SO2+2HCl,随着SOCl2的通入,能够消耗MgCl2·6H2O分解产生的水,同时生成的HCl抑制了MgCl2的水解。


科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂物质的量之比为 1∶2 的是 ( )
A.3S+6NaOH= 2Na2S+ Na2SO3+3H2O
B.2 CH3COOH+Ca(ClO)2=2HClO+Ca(CH3COO)2
C.I2+2NaClO3=2NaIO3+Cl2
D.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子的浓度变化如图所示(第一次平衡时c(I-)=2×10-3mol·L-1,c(Pb2+)=1×10-3mol·L-1),下列说法不正确的是

A.常温下,PbI2的Ksp=4×10-9
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度减小,Pb2+浓度不变
C.T时刻可能向溶液中加入了KI固体,Ksp不变
D.常温下Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下Cu能与Fe3+发生反应:Cu+2Fe3+=Cu2++2Fe2+现将铜粉与二氧化二铁的混合物22.4g加入到1mol/L的H2SO4溶液中进行反应。
(1)若固体恰好溶解,消耗硫酸的体积为V,则V的取值范围是_______。
(2)若硫酸溶液过量,反应后溶液的体积为1L,测得此溶液中Fe2+的浓度为0.1mol/L,则混合物中含铜_______g或_______g(只需写出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一些常见元素的单质或化合物之间的转化关系。溶液中的水及部分反应物或生成物未标出。A、E是空气的两种主要成分;反应①是在1500℃隔绝空气的条件下发生的,其中生成物D是单质。C是由两种元素组成的新型材料,且和SiC具有相同的最外层子数和原子数,J是一种能引起温室效应的气体,K是两性化合物,反应③、④、⑤用于工业中生产H。
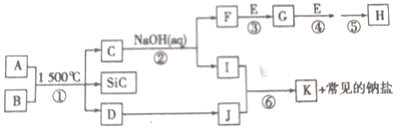
请回答下列问题。
(1)A的电子式:_____________;I的化学式:_____________;H的化学式:_____________。
(2)写出反应③的化学方程式:____________。
(3)写出反应⑥的离子方程式(J少量):_________。写出反应②的离子方程式:_________。
(4)B和SiC的纳米级复合粉末是新一代大规模集成电路理想的散热材料,反应①是科学家研究开发制备该纳米级复合材料的最新途径。已知:B由Si及另外两种元素组成,且Si与另外两种元素的物质的量之比均为1:4。请写出反应①的化学方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取、净化并收集氯气涉及以下几个主要阶段:
![]()
(1)写出实验室制取![]() 的离子方程式______________,
的离子方程式______________,![]() 表示阿伏伽德罗常数,若有
表示阿伏伽德罗常数,若有![]() 的
的![]() 被氧化,则转移的电子总数为______________;将足量的MnO2投入到含2mol HCl的浓盐酸中,充分加热,可生成Cl2______________(填>0.5mol;=0.5mol;<0.5mol)
被氧化,则转移的电子总数为______________;将足量的MnO2投入到含2mol HCl的浓盐酸中,充分加热,可生成Cl2______________(填>0.5mol;=0.5mol;<0.5mol)
(2)现有以下3种试剂:A.饱和食盐水B.浓硫酸C.![]() 溶液,请在以上试剂中选择并回答填空:Y溶液应选用___________ (填写序号):X试剂的作用_________。
溶液,请在以上试剂中选择并回答填空:Y溶液应选用___________ (填写序号):X试剂的作用_________。
(3)某兴趣小组的同学为探究和比较![]() 和氯水的漂白性,设计了如下的实验装置。
和氯水的漂白性,设计了如下的实验装置。

①实验室用装置![]() 制备
制备![]() 。某同学在实验时发现打开
。某同学在实验时发现打开![]() 的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:_______;
的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:_______;
②反应开始一段时间后,观察到![]() 、
、![]() 两试管中的品红溶液都出现褪色的现象,取下后两试管外观无区别,请你帮助设计实验加以鉴别,你的操作是____________。
两试管中的品红溶液都出现褪色的现象,取下后两试管外观无区别,请你帮助设计实验加以鉴别,你的操作是____________。
③若左右气体流速相同,写出C烧杯中的化学方程式____________。(写总方程式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3和CuCl2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中FeCl3与CuCl2的物质的量浓度之比为

A. 3∶1 B. 1∶2 C. 2∶1 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。
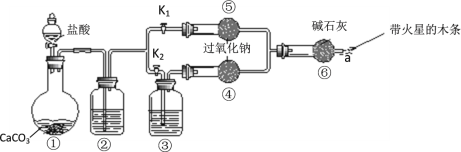
(装置分析)
(1)装置①中反应的离子方程式是___________;
(2)装置②中的试剂是______(填字母),装置③中的试剂是_________(填字母);
a 饱和NaHCO3溶液 b 饱和Na2CO3溶液 c 浓H2SO4 d NaOH溶液
(进行实验)
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(3)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是
步骤1中_____________,步骤2中_____________;
(4)步骤2中过氧化钠跟二氧化碳反应的化学方程式是_______________;
(实验反思)
(5)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应” 。其理由是____________;
(6)需要补充的实验操作是:取⑤中反应后的少量固体,______________;
(测定实验)测定反应后⑤中固体CO32-的质量分数
(7)将反应后⑤中固体,称量质量为ag。将ag固体溶于水,加入__________(填“BaCl2”或“CaCl2”)溶液,与未选物质相比的优点是___________。将生成的沉淀过滤、洗涤、干燥、称量,得固体质量为bg,计算质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所给信息或标志,判断下列说法错误的是()
A.在实验室和生产生活中,安全都是避免伤害和事故的保障—用肥皂液涂在天然气管道接口处检验是否漏气
B. 在运送硫酸的油罐车上贴有该标志
在运送硫酸的油罐车上贴有该标志
C. 看到有该标志的丢弃物,应远离并报警
看到有该标志的丢弃物,应远离并报警
D. 贴有该标志的物品是可回收物
贴有该标志的物品是可回收物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com