
����Ŀ����ͼ��һЩ����Ԫ�صĵ��ʻ���֮���ת����ϵ����Һ�е�ˮ�����ַ�Ӧ���������δ�����A��E�ǿ�����������Ҫ�ɷ֣���Ӧ������1500����������������·����ģ�����������D�ǵ��ʡ�C��������Ԫ����ɵ����Ͳ��ϣ��Һ�SiC������ͬ�������������ԭ������J��һ������������ЧӦ�����壬K�����Ի������Ӧ�ۡ��ܡ������ڹ�ҵ������H��
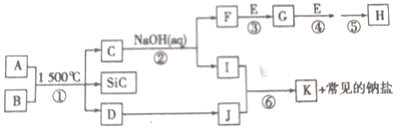
��ش��������⡣
��1��A�ĵ���ʽ��_____________��I�Ļ�ѧʽ��_____________��H�Ļ�ѧʽ��_____________��
��2��д����Ӧ�۵Ļ�ѧ����ʽ��____________��
��3��д����Ӧ�����ӷ���ʽ��J��������_________��д����Ӧ�ڵ����ӷ���ʽ��_________��
��4��B��SiC���������Ϸ�ĩ����һ�����ģ���ɵ�·�����ɢ�Ȳ��ϣ���Ӧ���ǿ�ѧ���о������Ʊ����������ϲ��ϵ�����;������֪��B��Si����������Ԫ����ɣ���Si����������Ԫ�ص����ʵ���֮�Ⱦ�Ϊ1��4����д����Ӧ�ٵĻ�ѧ����ʽ��_________��
���𰸡�![]() NaAlO2 HNO3 4NH3+5O2
NaAlO2 HNO3 4NH3+5O2 4NO+6H2O CO2+2AlO2-+3H2O
4NO+6H2O CO2+2AlO2-+3H2O![]() 2Al��OH��3��+CO32- AlN+H2O+OH-=AlO2-+NH3�� Al4SiC4+2N2
2Al��OH��3��+CO32- AlN+H2O+OH-=AlO2-+NH3�� Al4SiC4+2N2 ![]() 4AlN+SiC+3C
4AlN+SiC+3C
��������
A��E�ǿ����е�������Ҫ�ɷ֣��ֱ�ΪO2��N2�е�һ�֣�A��B��Ӧ�õ�C��SiC��D����Ԫ���غ��֪B�����ٺ���Si��CԪ�أ�D��E��Ӧ�õ�J��һ������������ЧӦ�����壬��JΪCO2��C������������Һ��Ӧ�õ�F��I��I��J��Ӧ�õ����Ի�����K�����Σ���KΪAl��OH��3����B�к���Si��C��Al����Ԫ�أ�C��������Ԫ����ɵ����Ͳ��ϣ�����C��ԭ����������������֮����SiC��ͬ����CΪAlN����AΪN2��DΪ̼��EΪO2��FΪNH3��IΪNaAlO2����ת����ϵ��֪GΪNO����Ӧ�ۡ��ܡ������ڹ�ҵ������H��ӦΪ���Ĵ���������ҵ������ķ�Ӧ������HΪHNO3���ݴ˽��
��1��������ķ�����֪��A�Ļ�ѧʽ��N2�����ʽ��![]() �� IΪNaAlO2��H�Ļ�ѧʽ��HNO3��
�� IΪNaAlO2��H�Ļ�ѧʽ��HNO3��
�ʴ�Ϊ��![]() ��NaAlO2��HNO3��
��NaAlO2��HNO3��
��2����Ӧ��Ϊ�����Ĵ�������Ӧ����Ӧ�ķ���ʽΪ4NH3+5O2 4NO+6H2O��
4NO+6H2O��
�ʴ�Ϊ��4NH3+5O2 4NO+6H2O��
4NO+6H2O��
��3����Ӧ��Ϊ������̼��ƫ�����Ƶķ�Ӧ����Ӧ�����ӷ���ʽΪCO2+2AlO2-+3H2O=2Al��OH��3��+CO32-����Ӧ�ڷ�Ӧ����AlN������������Һ��Һ��Ӧ����ƫ�����ƺͰ�������Ӧ�����ӷ���ʽ��AlN+H2O+OH-=AlO2-+NH3����
�ʴ�Ϊ��CO2+2AlO2-+3H2O=2Al��OH��3��+CO32-��AlN+H2O+OH-=AlO2-+NH3����
��4��A�к���Al��Si��C��Ԫ�أ�Si����������Ԫ�ص����ʵ���֮�Ⱦ�Ϊ1��4��ӦΪAl4SiC4���뵪����Ӧ����AlN��SiC��C��
��Ӧ�ķ���ʽΪAl4SiC4+2N2 ![]() 4AlN+SiC+3C��
4AlN+SiC+3C��
�ʴ�Ϊ��Al4SiC4+2N2 ![]() 4AlN+SiC+3C��
4AlN+SiC+3C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������ȷ���ǣ�������
A.�ɷ�Ӧ��M(s)+N(g) ![]() R(g) ��H1 ��M(g)+N(g)
R(g) ��H1 ��M(g)+N(g) ![]() R(g) ��H2����H 2����H 1
R(g) ��H2����H 2����H 1
B.��֪��2SO2(g)+O2(g) ![]() 2SO3(g)����H=��98.3kJ/mol����1molSO2��0.5molO2����һ�ܱ������з�Ӧ���ų�49.15kJ������
2SO3(g)����H=��98.3kJ/mol����1molSO2��0.5molO2����һ�ܱ������з�Ӧ���ų�49.15kJ������
C.��⾫��ͭʱ����Դ�����봿ͭ�������ҵ������ҺŨ��ʼ�ձ��ֲ���
D.�ö��Ե缫��� Na2SO4��Һ������������1mol����ʱ���ɼ�18 g ˮʹ��Һ�ָ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҷ����������ᣬ�����ǻ�ѧѧϰС���ͬѧ�Բ��ᾧ��(H2C2O4��xH2O)���е�̽����ѧϰ�Ĺ��̣�������벢Э������������ѧϰ������ͬѧ���о������ǣ�̽���ⶨ���ᾧ��(H2C2O4��xH2O)�е�xֵ��ͨ���������Ϻ������Ѱ�ã�����������ˮ��ˮ��Һ����������KMnO4��Һ���еζ���2MnO4-��5H2C2O4��6H��===2Mn2����10CO2����8H2O,ѧϰС���ͬѧ����˵ζ��ķ����ⶨxֵ��
�ٳ�ȡ1.260 g�����ᾧ�壬�����Ƴ�100.00 mLˮ��ҺΪ����Һ��
��ȡ25.00 mL����Һ������ƿ�У��ټ���������ϡH2SO4��
����Ũ��Ϊ0.1000 mol��L��1������KMnO4����Һ���еζ����ﵽ�յ�ʱ����10.00 mL��
(1)�ζ�ʱ��������KMnO4��Һװ����ͼ�е�________(����������������)�ζ����С�
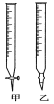
(2)��ʵ��ζ��ﵽ�յ�ı�־��___________________��
(3)ͨ���������ݣ����x��________��
���ۣ������ζ��յ�ʱ���ӵζ��̶ܿȣ����ɴ˲�õ�xֵ��________(����ƫ��������ƫС����������������ͬ)��
�����ζ�ʱ���õ�����KMnO4��Һ����ö�����Ũ�ȱ�С�����ɴ˲�õ�xֵ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йصζ���˵����ȷ���ǣ� ��
A. ��25mL�ζ��ܽ����к͵ζ�ʱ����ȥ��Һ�����Ϊ21.7mL
B. �ñ���KOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ���Ʊ���Һ�Ĺ���KOH����NaOH���ʣ�����ƫ��
C. ��C1mol/L���Ը��������Һ�ζ�V2mLδ֪Ũ�ȵ�H2C2O4��Һ�����ζ��յ���ȥ���Ը��������Һ���ΪV1mL����H2C2O4��Һ��Ũ��Ϊ![]() mol/L
mol/L
D. ��δ֪Ũ�ȵ�����ζ���֪Ũ�ȵ�NaOH��Һʱ������ȡ����ʱ���ζ�ǰ���ӣ��ζ����յ���ӣ��ᵼ�²ⶨ���ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�pH��Ϊ2�������ΪV0��HA��HB��HC��Һ���ֱ��ˮϡ�������ΪV����ҺpH��lg![]() �ı仯��ϵ��ͼ��ʾ����������������ǣ� ��
�ı仯��ϵ��ͼ��ʾ����������������ǣ� ��
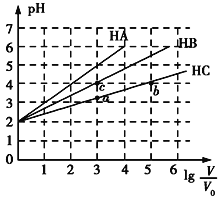
A.�����£�Ka(HB)>Ka(HC)
B.HC�ĵ���ȣ�a��<b��
C.��lg![]() =4ʱ��������Һͬʱ�����¶ȣ�
=4ʱ��������Һͬʱ�����¶ȣ�![]() ��С
��С
D.��lg![]() =5ʱ��HA��Һ��pHΪ7
=5ʱ��HA��Һ��pHΪ7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������Ű�ҹ��ֵ���������SO2����ɿ�����Ⱦ����Ҫԭ�������Ƽ�ѭ�����ɳ�ȥSO2��
��1���Ƽ�ѭ�����У�Na2SO3��Һ�ʼ��Ե�ԭ����_____���������ӷ���ʽ��ʾ��
��2����֪H2SO3�ĵ��볣��ΪK1=1.5��10-2��K2=1.0��10-7��H2CO3�ĵ��볣��ΪK1=4.3��10-7��K2=5.6��10-11�������������Դ����������_____(�����)��
A.CO32-��HSO3- B.HCO3-��HSO3- C.H2SO3��HCO3- D.SO32-��HCO3-
��3������������Ϣ������Һ��pH=5ʱ����Һ��![]() =_________���������ֵ����
=_________���������ֵ����
��4������Һ����SO2�Ĺ����У�ˮ��Һ��H2SO3��HSO3-��SO32-��pH�ķֲ���ͼ��

������SO2�Ʊ�NaHSO3��Һ��ʵ����ȷ����ʱֹͣͨSO2��ʵ�����Ϊ_________��
����0.1mol��L1NaHSO3��Һ������Ũ�ȹ�ϵ����ȷ����_________(�����)��
A.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) B.c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)
C.c(H2SO3)+c(H+)=c(SO32��)+c(OH-) D.c(Na+)+c(H+)=c(SO32��)+c(HSO3-)+c(OH-)
��5����������(SOCl2)�����Ȼ���������һ��Һ̬�ķǵ���ʣ��е�Ϊ77����SOCl2����Ԫ������Ԫ��ֱ���Թ��ۼ�����������Cl��1�ۣ�SOCl2��ˮ������SO2����ش��������⣺����MgCl2��Һ���ܵõ���ˮMgCl2������SOCl2��MgCl2��6H2O��ϲ����ȣ����Ƶ���ˮMgCl2������SOCl2��ˮ��Ӧ�ķ���ʽ�ͱ�Ҫ��������������ԭ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽ��д��ȷ���ǣ� ��
A.HCO3-��ˮ��Һ�еĵ��뷽��ʽ��HCO3- ��H2O![]() H3O����CO32-
H3O����CO32-
B.H2SO3�ĵ��뷽��ʽH2SO3![]() 2H����SO32-
2H����SO32-
C.CO32-��ˮ�ⷽ��ʽ��CO32- ��2H2O![]() H2CO3��2OH-
H2CO3��2OH-
D.CuSO4��ˮ�ⷽ��ʽ�� Cu2++2H2O=Cu(OH)2��+2H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Mg��Al��ɵ�mg�����Ͷ��һ����ϡHCl�У�������ȫ�ܽ⣬�ռ�������Ϊ1.12L����״��������Ӧ����Һ�м���2 mol/L NaOH��Һ60mLʱ����������ǡ�ó�����ȫ�����γɳ���������Ϊ��������
A.��m+1.7��gB.��m+2.04��gC.��m+3.4��gD.��m+4.08��g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1molij���������г��ȼ������CO2��H2O����Ҫ���ı�״���µ�����179.2L�����ڹ��յ���������������Ӧ���������ֲ�ͬ��һ��ȡ��������Ľṹ��ʽ��
A.CH3CH2CH2CH2CH3B.![]()
C.![]() D.
D.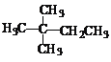
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com