
【题目】某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。
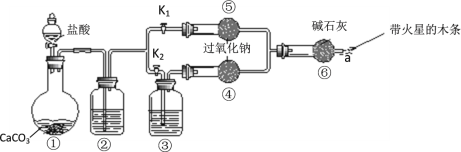
(装置分析)
(1)装置①中反应的离子方程式是___________;
(2)装置②中的试剂是______(填字母),装置③中的试剂是_________(填字母);
a 饱和NaHCO3溶液 b 饱和Na2CO3溶液 c 浓H2SO4 d NaOH溶液
(进行实验)
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(3)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是
步骤1中_____________,步骤2中_____________;
(4)步骤2中过氧化钠跟二氧化碳反应的化学方程式是_______________;
(实验反思)
(5)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应” 。其理由是____________;
(6)需要补充的实验操作是:取⑤中反应后的少量固体,______________;
(测定实验)测定反应后⑤中固体CO32-的质量分数
(7)将反应后⑤中固体,称量质量为ag。将ag固体溶于水,加入__________(填“BaCl2”或“CaCl2”)溶液,与未选物质相比的优点是___________。将生成的沉淀过滤、洗涤、干燥、称量,得固体质量为bg,计算质量分数。
【答案】CaCO3+2H+= Ca2++H2O+CO2↑ a c 步骤1中木条不复燃 步骤2中木条复燃 ![]() 气体中有水,水也可与Na2O2反应产生O2使木条复燃 加入稀盐酸,将产生的气体通入澄清的石灰水中【或加BaCl2溶液等体现检验CO32-的方法即可,加CaCl2不给分】 BaCl2 生成沉淀质量更大,相对误差更小【或加CaCl2会产生微溶的Ca(OH)2】
气体中有水,水也可与Na2O2反应产生O2使木条复燃 加入稀盐酸,将产生的气体通入澄清的石灰水中【或加BaCl2溶液等体现检验CO32-的方法即可,加CaCl2不给分】 BaCl2 生成沉淀质量更大,相对误差更小【或加CaCl2会产生微溶的Ca(OH)2】
【解析】
将碳酸钙和稀盐酸反应生成二氧化碳、氯化钙和水,先除掉二氧化碳中的HCl气体,一部分气体直接通入过氧化钠,另一部分先干燥再通入过氧化钠中,验证有无氧气;但也有可能是过氧化钠和水在反应,因此要验证产物中是否生成了碳酸根,常用氯化钡来验证。
⑴装置①中反应的离子方程式是CaCO3+2H+ = Ca2++H2O+CO2↑;故答案为:CaCO3+2H+= Ca2++H2O+CO2↑。
⑵装置②中的试剂主要是除掉HCl,因此用a,装置③中的试剂主要干燥二氧化碳气体,因此用c;故答案为:a;c。
⑶步骤1中没有氧气生成,因此木条不复燃,步骤2中产生了氧气,因此使木条复燃;故答案为:木条不复燃;木条复燃。
⑷步骤2中过氧化钠跟二氧化碳反应的化学方程式是2Na2O2+2CO2 ![]() 2Na2CO3+O2↑;故答案为:2Na2O2+2CO2
2Na2CO3+O2↑;故答案为:2Na2O2+2CO2 ![]() 2Na2CO3+O2↑。
2Na2CO3+O2↑。
⑸有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应” 。其理由是气体中有水,水也可与Na2O2反应产生O2使木条复燃;故答案为:气体中有水,水也可与Na2O2反应产生O2使木条复燃。
⑹需要补充的实验主要是验证有碳酸钠生成,通过反应生成二氧化碳来验证,因此操作是:取⑤中反应后的少量固体加入稀盐酸,将产生的气体通入澄清的石灰水中[或加BaCl2溶液等体现检验CO32-的方法即可,加CaCl2不给分];故答案为:加入稀盐酸,将产生的气体通入澄清的石灰水中[或加BaCl2溶液等体现检验CO32-的方法即可,加CaCl2不给分]。
⑺将反应后⑤中固体,称量质量为ag。将ag固体溶于水,加入BaCl2溶液,生成碳酸钡沉淀,与氯化钙反应生成碳酸钙和氢氧化钙,因此与未选物质相比的优点是生成沉淀质量更大,相对误差更小[或加CaCl2会产生微溶的Ca(OH)2];故答案为:BaCl2溶液;生成沉淀质量更大,相对误差更小[或加CaCl2会产生微溶的Ca(OH)2]。


科目:高中化学 来源: 题型:
【题目】(1)原子序数大于4的主族元素A和B的离子Am+和Bn-它们的核外电子排布相同,据此推断:
①A和B所属周期数之差为___________
②A和B的核电荷数之差为____________(用含m、n的代数式表示)
③B和A的族序数之差为______________(用含m、n的代数式表示)
(2)A、B两元素,A的原子序数为x,A和B所在周期包含元素种类数目分别为m和n。回答下列问题:
①如果A和B同在ⅠA族,当B在A的上一周期时,B的原子序数为_____________;当B在A的下一周期时,B的原子序数为______________;
②如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为___________当B在A的下一周期时,B的原子序数为______________。
(3)某粒子的结构示意图为: 试回答:
试回答:
①当x-y=10时,该粒子为________(填“原子”或“阳离子”“阴离子”)
②当y=8时,该粒子可能是(写名称):_______、________、_______、_______、_______。
③写出y=3与y=7的元素最高价氧化物对应水化物发生反应的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近雾霾天气肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,Na2SO3溶液呈碱性的原因是_____。(用离子方程式表示)
(2)已知H2SO3的电离常数为K1=1.5×10-2,K2=1.0×10-7;H2CO3的电离常数为K1=4.3×10-7,K2=5.6×10-11;则下列微粒可以大量共存的是_____(填序号)。
A.CO32-和HSO3- B.HCO3-和HSO3- C.H2SO3和HCO3- D.SO32-和HCO3-
(3)根据上述信息,当溶液的pH=5时,溶液中![]() =_________(填具体数值)。
=_________(填具体数值)。
(4)吸收液吸收SO2的过程中,水溶液中H2SO3、HSO3-、SO32-随pH的分布如图:

①吸收SO2制备NaHSO3溶液,实验中确定何时停止通SO2的实验操作为_________。
②在0.1mol·L1NaHSO3溶液中离子浓度关系不正确的是_________(填序号)。
A.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) B.c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)
C.c(H2SO3)+c(H+)=c(SO32-)+c(OH-) D.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(5)亚硫酰氯(SOCl2)又名氯化亚砜,是一种液态的非电解质,沸点为77℃。SOCl2中氯元素与硫元素直接以共价键相连,其中Cl呈1价;SOCl2遇水可生成SO2。请回答下列问题:蒸干MgCl2溶液不能得到无水MgCl2,若将SOCl2与MgCl2·6H2O混合并加热,可制得无水MgCl2,请用SOCl2与水反应的方程式和必要的文字描述解释原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体铝钠合金(钠和铝熔合而成)可用于核反应堆的载热介质。下列有关说法不正确的是( )
A.自然界中没有游离的钠和铝
B.若铝钠合金投入水中无固体剩余,则n(Al)≤n(Na)
C.铝钠合金投入到氯化铜溶液中,一定有氢氧化铜沉淀,也可能有铜析出
D.相同质量不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Mg、Al组成的mg混合物投入一定量稀HCl中,固体完全溶解,收集到气体为1.12L(标准状况),向反应后溶液中加入2 mol/L NaOH溶液60mL时,金属离子恰好沉淀完全,则形成沉淀的质量为( )
A.(m+1.7)gB.(m+2.04)gC.(m+3.4)gD.(m+4.08)g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水作为还原剂的是( )
A.2Na2O2+2H2O═4NaOH+O2↑B.3NO2+H2O═2HNO3+NO
C.2F2+2H2O═4HF+O2D.3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,密闭容器中发生![]() △H=-a kJ·mol-1(a>0),反应过程中速率随时间的变化如图所示,下列说法不正确的是
△H=-a kJ·mol-1(a>0),反应过程中速率随时间的变化如图所示,下列说法不正确的是

A.t1时刻X的正反应速率等于Z的正反应速率
B.t2时刻可逆反应达到平衡状态
C.t2时刻以后,平均反应速率为0,说明反应不再发生
D.0~t2时间内反应放出的热量可能是akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废铝屑中含有少量杂质Al2O3、SiO2。取一定量该废铝屑样品,加入2mol/L的硫酸溶液,消耗600mL硫酸溶液时样品不再溶解,收集到标准状况下的气体8.96 L,过滤。欲使滤液中的金属离子完全沉淀,至少应加入3mol/LNaOH溶液的体积是
A.300mLB.600mLC.800mLD.900mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.9g 13CO2与N217O的混合物中所含中子数目为4.6NA
B.1L 0.1 mol·L-1 Na2CO3溶液中,CO32-离子数小于0.1NA
C.7.1g Cl2与足量NaOH溶液反应转移的电子数为0.2NA
D.14g乙烯中含有的共用电子对数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com