
| 稀硫酸 |
| 足量NaOH |
| 蒸干、灼烧 |
| 一定条件 |
| 120℃ | 300℃ | 480℃ | |
| 化学式 | KxFey(C2O4)Z | KxFeyO(C2O4)Z-1 | KxFeyO2(C2O4)Z-2 |
| 质量 | 4.370g | 3.650g | 2.930g |
| m |
| n |
| 0.54g |
| 4.91g |
| 0.72g |
| 72g/mol |
| 4.91g |
| 0.01mol |
| 0.8g |
| 180g/mol |
| 491-39×9-88×3 |
| 18 |


科目:高中化学 来源: 题型:
| A、沸点:NH3>PH3>AsH3 |
| B、熔点:Li>Na>K |
| C、酸性:HClO4>H2SO4>H3PO4 |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 3.0×10-8 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A、等物质的量的Na2CO3和CH3COOH两种溶液混合,一定 有:c(Na+)+c(H+)=2c(CO32-)+c (HCO3-)+c (CH3COO-) |
| B、常温下,已知酸H2A存在如下平衡:H2A?H++HA-;HA-?H++A2-(Ka1=5.9xl0-2,Ka2=6.4xl0'6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度 |
| C、相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c (Na+)>c (ClO-)>c (CH3COO-)>c (OH-)>c (H+) |
| D、常温下,在O.lmol/LCH3COOH溶液中滴加O.lmol/LNaOH的溶液发生反应,当c(CH3COOH):c (CH3COO-)=5:9时,此时溶液pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaOH溶液中滴加水 |
| B、向稀盐酸中滴加NaOH溶液 |
| C、向NaCl溶液中滴加稀盐酸 |
| D、向NaOH溶液中滴加稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原于有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同,D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为25.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原于有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同,D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为25.查看答案和解析>>
科目:高中化学 来源: 题型:
 铝及其化合物用途广泛
铝及其化合物用途广泛查看答案和解析>>
科目:高中化学 来源: 题型:

| A、按系统命名法命名时,(图1)化合物的名称是2,4,6-三甲基-5-乙基庚烷 |
| B、有机物(图2)的一种芳香族同分异构体能发生银镜反应 |
| C、高分子化合物(图3),其单体为对苯二甲酸和乙醇 |
| D、等质量的乙炔和苯完全燃烧生成水的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将二氧化碳通人硅酸钠溶液以证明碳酸的酸性比硅酸强 |
B、如图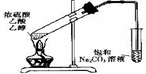 装置中,导管不能伸人液面的原因是产物易溶于水 装置中,导管不能伸人液面的原因是产物易溶于水 |
| C、用碱石灰可干燥氯气 |
| D、用普通玻璃棒蘸取溶液做焰色反应以证明溶液含有Na十 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 信息 |
| B | 其单质在常温下为双原子分子,与A可形成分子X,X的水溶液呈碱性 |
| D | 其氧化物具有两性 |
| E | 元素原子最外层比次外层少2个电子 |
| C、F | 两种元素的原子最外层共有13个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com