
【题目】T1和T2温度下(T1>T2),BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )

A. T1时,c点有沉淀生成
B. T2时,蒸发溶剂可能由d点变到b点
C. T2时,由a点开始加入BaCl2固体,Ksp增大
D. BaSO4的溶解度随温度升高而增大
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】己知H-H键键能(化学键断裂时吸收或形成时释放的能量)为436 kJ/mol,N-H键键能为391 kJ/mol,根据热化学方程式:N2(g)+3H2(g)=2NH3(g) △H =-92.4 kJ/mol,可知 N≡N键的键能是
A. 431kJ/molB. 946 kJ/molC. 649 kJ/molD. 896 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知:Cu2O+2H+=Cu+Cu2++H2O。
(1)操作Ⅰ的名称为________;灼烧操作中常用的实验仪器有酒精灯、三角架,还有________(夹持仪器不写)。
(2)固体混合物B的主要成分为______(写化学式);滤液A中铁元素的存在形式只能为 Fe2+,理由是________。检验滤液A中Fe2+的试剂为_______(填试剂名称)。
(3)滤液中C铝元素的主要存在形式为______(填离子符号),写出对应的离子方程式______。
(4)某同学认为滤液NaAIO2的水解程度是微弱的,AIO2-的水解不超过总量的10%,请设计实验验证该同学的观点是否正确_________。
(5)从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,主要步骤:称取一定质量的样品→________________(填缺少的操作步骤,不必描述操作过程的细节)→过滤、洗涤、干燥→称量剩余固体铜的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物的结构简式如右图,有关该化合物的叙述不正确的是( )

A. 该有机物的分子式为C11H12O2
B. 1mol该物质最多能与4molH2发生加成反应
C. 该有机物一定条件下,可以发生取代、氧化、聚合、酯化反应
D. 该有机物能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)目前,应用最广泛的烟气氮氧化物脱除技术是NH3催化还原法,化学反应可表示为:
2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) △H<0
①该反应中,反应物总能量_____(填“>”、“<”或“=”)生成物总能量。
②当该反应有2mol N2(g)生成时,转移电子的物质的量为__mol。
③该反应中,还原剂为______(填化学式),氧化产物与还原产物的质量比为______________。
(2)也可以利用甲烷催化还原氮氧化物.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是_________________。
(3)还可利用ClO2消除氮氧化物的污染,反应过程如下(部分反应物或生成物略去):![]()
反应I的产物中还有两种强酸生成,且其中一种强酸为硝酸,且硝酸与NO3物质的量相等,则化学反应方程式为______,反应中若生成22.4L N2(标准状况),则消耗ClO2______g。
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。

①氢氧燃料电池的能量转化主要形式是________,工作时电流方向为________(用a、b和箭头表示)。
②负极的电极反应式为__________________。
③电极表面镀铂粉的原因为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于水与生命活动的说法,不正确的是
A. 细胞发生癌变,其自由水含量较正常细胞的低
B. 正在萌发的种子中结合水与自由水的比值降低
C. 在线粒体,叶绿体和核糖体中进行的化学反应都有水生成
D. 自由水和结合水在一定的条件下可以相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D四种元素,原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素。试回答下列有关的问题:
(1)写出D元素价电子的电子排布式:______________。
(2)D可形成化合物[D(H2O)6](NO3)3 。
①[D(H2O)6](NO3)3中阴离子的立体构型是_____________。NO3-中心原子的轨道杂化类型为__________。
②在[D(H2O)6] 3+中D3+与H2O之间形成的化学键称为______,1 mol [D(H2O)6] 3+ 中含有的σ键有________mol。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中________(填化学式)为非极性分子。另一种物质的电子式为_____________。
(4)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图以及晶胞的剖面图:
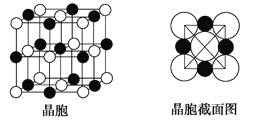
晶胞中距离一个A+最近的C-有________个,这些C-围成的图形是______________,若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则A+的离子半径为________cm(用含NA与ρ的式子表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酰氯(COC12),俗称光气,常温下为气体,化学性质不稳定,遇水迅速水解得到强酸,工业用途广泛,是化工制品的重要中间体。
(1)实验室可利用氧气与氯仿(CHCl3)反应得到光气和一种氢化物,写出氧气与氯仿(CHC13)反应的化学反应方程式:_____________________________。
(2)工业上,常用CO与氯气反应得到光气,其热化学方程式为:CO(g)+Cl2(g)![]() COCl2(g) △H=-108 kJ/mol,已知:1 molCl2(g)、1molCO(g)化学键断裂分别需要吸收能量243kJ、1072kJ,则1molCOCl2(g)中化学键断裂需要吸收能量________kJ。
COCl2(g) △H=-108 kJ/mol,已知:1 molCl2(g)、1molCO(g)化学键断裂分别需要吸收能量243kJ、1072kJ,则1molCOCl2(g)中化学键断裂需要吸收能量________kJ。
(3)光气的分解反应为 COCl2(g)![]() CO(g)+Cl2(g) △H=+l08kJ/mol。温度为T1时,该可逆反应在恒容密闭体系中,各物质的浓度与时间关系如下表所示:
CO(g)+Cl2(g) △H=+l08kJ/mol。温度为T1时,该可逆反应在恒容密闭体系中,各物质的浓度与时间关系如下表所示:
浓度/mol L-1 时间/min | COCl2(g) | CO(g) | Cl2(g) |
0 | 0.1300 | 0.0050 | 0.0050 |
5 | 0.0400 |
①在5 min 时恰好达到平衡状态,该反应在此温度下的平衡常数K=________(精确到小数点后两位)。
②0~5min 内,v(COCl2)=_________。
③若保持温度不变,再向容器中充入一定量COCl2 (g),重新达到平衡,此时COCl2 (g)的转化率a(COCl2)_________(填“增大”“减小”或“不变”),试用平衡常数解释原因______________________。
④保持其他条件不变,改变反应温度至T2,反应重新达到平衡,此时测得c(CO)=0.0850 mol/L,则T1________T2(填“>”、“<”、“=”),理由是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存与发展比不可缺的,甲醇、甲醚(CH3OCH3)均是“清洁能源”,工业上可以通过多种方法合成它们。
(1)以CO、H2为原料合成甲醚的过程中,在反应器中发生了下列反应:
a.CO(g)+2H2(g)![]() CH3OH(g) △H=- 90kJ mol-1
CH3OH(g) △H=- 90kJ mol-1
b.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23 kJ mol-1
CH3OCH3(g)+H2O(g) △H=-23 kJ mol-1
c.CO(g)+ H2O(g)![]() CO2(g)+H2(g) △H=-41 kJ mol-1
CO2(g)+H2(g) △H=-41 kJ mol-1
①选取适当的催化剂,在一定压强下,向某恒容密闭容器中通入H2和CO制备甲醚,测得的有关数据如图1所示。则制备甲醚时较适宜的生产温度范围是____________,通过理论分析得知反应c的存在能提高甲醚的产率,原因是________________________________________________。

②3CO(g)+3H2(g)![]() CH3OCH3(g)+ CO2(g) △H,则△H=____________。
CH3OCH3(g)+ CO2(g) △H,则△H=____________。
(2)用下列反应也可得到甲醚:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)。已知TK时,该反应的化学平衡常数K=1。则在相同温度下,当一恒容密闭容器中c(CO2)=2.0×10-2mol·L-1、c(H2)=1.0×10-2mol·L-1、c(CH3OCH3)=1.0×10-4mol·L-1、c(H2O)=2.0×10-4mol·L-1时,v正____________ v逆(填“>”、“ <”或“=”)。
CH3OCH3(g)+3H2O(g)。已知TK时,该反应的化学平衡常数K=1。则在相同温度下,当一恒容密闭容器中c(CO2)=2.0×10-2mol·L-1、c(H2)=1.0×10-2mol·L-1、c(CH3OCH3)=1.0×10-4mol·L-1、c(H2O)=2.0×10-4mol·L-1时,v正____________ v逆(填“>”、“ <”或“=”)。
(3)控制适当的条件,CO2与H2也可转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。将CO2、H2按物质的量比为1∶3的比例加入到恒容密闭容器中反应。测得容器中n(CH3OH)在不同温度下随着时间的变化情况如图2所示.
CH3OH(g)+H2O(g)。将CO2、H2按物质的量比为1∶3的比例加入到恒容密闭容器中反应。测得容器中n(CH3OH)在不同温度下随着时间的变化情况如图2所示.
①该反应的△H____________0(填“>”、 “=”、“ <”,下同)
②若温度T1对应的化学平衡常数K1=10,则温度T2对应的化学平衡常数K2____________10。
③下列数据能说明该反应一定处于平衡状态的是____________(填选项字母)。
A.气体密度保持不变 B.n(H2)=0.3mol
C.CO2、H2的消耗速率比为1∶3 D.气体的平均相对分子质量保持不变
(4)图3为某绿色燃料电池的工作原理示意图,写出电池工作时负极上的电极反应式:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com