
ЎҫМвДҝЎҝIЈ®УРЛДЦЦ¶МЦЬЖЪФӘЛШЈ¬ЛьГЗөДҪб№№ЎўРФЦКөИРЕПўИзПВұнЛщКцЈә
ФӘЛШ | Ҫб№№ЎўРФЦКөИРЕПў |
A | КЗ¶МЦЬЖЪЦРЈЁіэПЎУРЖшМеНвЈ©ФӯЧУ°лҫ¶ЧоҙуөДФӘЛШЈ¬ёГФӘЛШөДДіЦЦәПҪрКЗФӯЧУ·ҙУҰ¶СөДөјИИјБ |
B | BУлAН¬ЦЬЖЪЈ¬ЖдЧоёЯјЫСх»ҜОпөДЛ®»ҜОпіКБҪРФ |
C | ФӘЛШөДЖшМ¬Зв»ҜОпј«ТЧИЬУЪЛ®Ј¬ҝЙУГЧчЦЖАдјБ |
D | КЗәЈЛ®ЦРіэЗвЎўСхФӘЛШНвә¬БҝЧо¶аөДФӘЛШЈ¬ЖдөҘЦК»т»ҜәПОпТІКЗЧФАҙЛ®ЙъІъ№эіМЦРіЈУГөДПы¶ҫЙұҫъјБ |
ЗлёщҫЭұнЦРРЕПўМоРҙЈә
ЈЁ1Ј©D©ҒөДҪб№№КҫТвНјКЗ___ЎЈ
ЈЁ2Ј©CФӘЛШөДЖшМ¬Зв»ҜОпөД»ҜС§КҪОӘЈә___Ј»ЖдјмСй·Ҫ·ЁЈә___ЎЈ
ЈЁ3Ј©BФӘЛШФЪЦЬЖЪұнЦРөДО»ЦГ___Ј»АлЧУ°лҫ¶ЈәB___AЈЁМоЎ°ҙуУЪЎұ»тЎ°РЎУЪЎұЈ©ЎЈ
ЈЁ4Ј©BөДЧоёЯјЫСх»ҜОп¶ФУҰөДЛ®»ҜОпУлAөДЧоёЯјЫСх»ҜОп¶ФУҰөДЛ®»ҜОп·ҙУҰөД»ҜС§·ҪіМКҪОӘ___Ј¬УлDөДЗв»ҜОпөДЛ®»ҜОп·ҙУҰөДАлЧУ·ҪіМКҪОӘ___ЎЈ
IIЈ®ФЪ2LГЬұХИЭЖчДЪЈ¬800ЎжКұ·ҙУҰЈә2NOЈЁgЈ©+O2ЈЁgЈ©2NO2ЈЁgЈ©МеПөЦРЈ¬nЈЁNOЈ©ЛжКұјдөДұд»ҜИзПВұнЈә
КұјдЈЁsЈ© | 0 | 1 | 2 | 3 | 4 | 5 |
nЈЁNOЈ©ЈЁmolЈ© | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

ЈЁ1Ј©NOөДЖҪәвЕЁ¶Иc/span>ЈЁNOЈ©ЈҪ___ЎЈ
ЈЁ2Ј©НјЦРұнКҫNO2ұд»ҜөДЗъПЯКЗ___Ј¬УГO2ұнКҫ0Ў«2sДЪёГ·ҙУҰөДЖҪҫщЛЩВКҰФЈҪ___ЎЈ
ЈЁ3Ј©ДЬЛөГчёГ·ҙУҰТСҙпөҪЖҪәвЧҙМ¬өДКЗ___ЎЈ
aЈ®ҰФЈЁNO2Ј©ЈҪ2ҰФЈЁO2Ј© bЈ®ИЭЖчДЪЖшМеС№ЗҝұЈіЦІ»ұд
cЈ®ҰФДжЈЁNOЈ©ЈҪ2ҰФХэЈЁO2Ј© dЈ®ИЭЖчДЪЖшМеөДГЬ¶ИұЈіЦІ»ұд
Ўҫҙр°ёЎҝ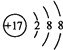 NH3 ·Ҫ·ЁТ»ЈәУГКӘИуөДәмЙ«КҜИпКФЦҪјмСйЈ¬КФЦҪұдА¶ЦӨГчУР°ұЖшЎЈ·Ҫ·Ё¶юЈәУГІЈБ§°фХәЕЁСОЛб»тХЯЕЁПхЛбҝҝҪьЈ¬ІъЙъ°ЧСМЈ¬ЦӨГчУР°ұЖш өЪИэЦЬЖЪөЪўуAЧе РЎУЪ AlЈЁOHЈ©3+NaOHЁTNaAlO2+2H2O 3H++AlЈЁOHЈ©3ЁTAl3++3H2O 0.0035mol/L b 0.0015mol/ЈЁLsЈ© bc
NH3 ·Ҫ·ЁТ»ЈәУГКӘИуөДәмЙ«КҜИпКФЦҪјмСйЈ¬КФЦҪұдА¶ЦӨГчУР°ұЖшЎЈ·Ҫ·Ё¶юЈәУГІЈБ§°фХәЕЁСОЛб»тХЯЕЁПхЛбҝҝҪьЈ¬ІъЙъ°ЧСМЈ¬ЦӨГчУР°ұЖш өЪИэЦЬЖЪөЪўуAЧе РЎУЪ AlЈЁOHЈ©3+NaOHЁTNaAlO2+2H2O 3H++AlЈЁOHЈ©3ЁTAl3++3H2O 0.0035mol/L b 0.0015mol/ЈЁLsЈ© bc
ЎҫҪвОцЎҝ
IЈ®AКЗ¶МЦЬЖЪЦР(іэПЎУРЖшМеНв)ФӯЧУ°лҫ¶ЧоҙуөДФӘЛШЈ¬ёГФӘЛШөДДіЦЦәПҪрКЗФӯЧУ·ҙУҰ¶СөДөјИИјБЈ¬ЛщТФAОӘДЖФӘЛШЈ¬BУлAН¬ЦЬЖЪЈ¬ЖдЧоёЯјЫСх»ҜОпөДЛ®»ҜОпіКБҪРФЈ¬ФтBОӘВБФӘЛШЈ¬CФӘЛШөДЖшМ¬Зв»ҜОпј«ТЧИЬУЪЛ®Ј¬ҝЙУГЧчЦЖАдјБЈ¬ФтCОӘөӘФӘЛШЈ¬DКЗәЈЛ®ЦРіэЗвЎўСхФӘЛШНвә¬БҝЧо¶аөДФӘЛШЈ¬ЖдөҘЦК»т»ҜәПОпТІКЗЧФАҙЛ®ЙъІъ№эіМЦРіЈУГөДПы¶ҫЙұҫъјБЈ¬ФтDОӘВИФӘЛШЈ¬ҫЭҙЛҙрМвЎЈ
IЈ®УЙ·ЦОцЦӘЈәAОӘNaФӘЛШЎўBОӘAlФӘЛШЎўCОӘNФӘЛШЎўDОӘClФӘЛШЈ»
(1)DОӘClФӘЛШЈ¬ФтCl©ҒөДҪб№№КҫТвНјКЗ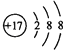 Ј»
Ј»
(2)CОӘNФӘЛШЈ¬ЖдЖшМ¬Зв»ҜОпөД»ҜС§КҪОӘNH3Ј»°ұЖшөДЛ®ИЬТәПФјоРФЈ¬іЈУГјмСйNH3өД·Ҫ·ЁЈә·Ҫ·ЁТ»ЈәУГКӘИуөДәмЙ«КҜИпКФЦҪјмСйЈ¬КФЦҪұдА¶ЦӨГчУР°ұЖшЎЈ·Ҫ·Ё¶юЈәУГІЈБ§°фХәЕЁСОЛб»тХЯЕЁПхЛбҝҝҪьЈ¬ІъЙъ°ЧСМЈ¬ЦӨГчУР°ұЖшЈ»
(3)BОӘAlФӘЛШЈ¬ЖдФЪЦЬЖЪұнЦРөДО»ЦГКЗөЪИэЦЬЖЪөЪўуAЧеЈ»Na+әНAl3+ҫЯУРПаН¬өДөзЧУІгҪб№№Ј¬әЛөзәЙКэҙуЈ¬АлЧУ°лҫ¶РЎЈ¬ФтАлЧУ°лҫ¶ЈәAl3+РЎУЪNa+Ј»
(4)Al(OH)3ИЬУЪNaOHЙъіЙNaAlO2әНЛ®Ј¬·ўЙъ·ҙУҰөД»ҜС§·ҪіМКҪОӘAl(OH)3+NaOHЁTNaAlO2+2H2OЈ¬Al(OH)3ИЬУЪПЎСОЛбКұ·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪОӘ3H++Al(OH)3ЁTAl3++3H2OЈ»
II.(1)3sәуТ»Сх»ҜөӘөДЕЁ¶ИұЈіЦІ»ұдЈ¬ЛөГч·ҙУҰҙпЖҪәвЧҙМ¬Ј¬ЛщТФNOөДЖҪәвЕЁ¶Иc(NO)ЈҪ![]() ЈҪ0.0035mol/LЈ»
ЈҪ0.0035mol/LЈ»
(2)УЙ(1)јЖЛгҝЙЦӘЈ¬ЖҪәвКұ¶юСх»ҜөӘөДЕЁ¶ИОӘ0.0065 mol/LЈ¬ЗТ¶юСх»ҜөӘОӘЙъіЙОпЈ¬ЛжЧЕКұјдөДНЖТЖ¶юСх»ҜөӘЕЁ¶ИФцҙуЈ¬ЗъПЯbЖҪәвКұөДЕЁ¶ИОӘ0.0065mol/LЈ¬№КЗъПЯbұнКҫNO2өДЕЁ¶Иұд»ҜЈ¬УЙНјЦРКэҫЭҝЙЦӘ2sДЪЈ¬NOөДЕЁ¶Иұд»ҜБҝОӘ0.01mol/L©Ғ0.004mol/LЈҪ0.006mol/LЈ¬№КҰФ(NO)ЈҪ![]() ЈҪ0.003mol/(Ls)Ј¬ёщҫЭЛЩВКЦ®ұИөИУЪ»ҜС§јЖБҝКэЦ®ұИЈ¬№КҰФ(O2)ЈҪ
ЈҪ0.003mol/(Ls)Ј¬ёщҫЭЛЩВКЦ®ұИөИУЪ»ҜС§јЖБҝКэЦ®ұИЈ¬№КҰФ(O2)ЈҪ![]() ҰФ(NO)ЈҪ
ҰФ(NO)ЈҪ![]() ЎБ0.003mol/(Ls)ЈҪ0.0015mol/(Ls)Ј¬
ЎБ0.003mol/(Ls)ЈҪ0.0015mol/(Ls)Ј¬
(3)a.ОҙЦёГчХэДжЛЩВКЈ¬Иф¶јОӘН¬Т»·ҪПтЛЩВКЈ¬КјЦХ¶јҙжФЪҰФ(NO2)ЈҪ2ҰФ(O2)№ШПөЈ¬№КІ»ДЬЛөГчөҪҙпЖҪәвЈ¬ИфОӘІ»Н¬·ҪПтөДЛЩВКЈ¬ЛЩВКЦ®ұИөИУЪ»ҜС§јЖБҝКэЦ®ұИЈ¬ЛөГчөҪҙпЖҪәвЈ¬Ј»
b.Лж·ҙУҰҪшРРЖшМеөДОпЦКөДБҝјхРЎЈ¬С№ЗҝјхРЎЈ¬ИЭЖчДЪС№ЗҝұЈіЦІ»ұдЈ¬ЛөГчөҪҙпЖҪәвЈ»
c.І»Н¬ОпЦКұнКҫөДХэДжЛЩВКЦ®ұИөИУЪ»ҜС§јЖБҝКэЦ®ұИЈ¬·ҙУҰөҪҙпЖҪәвЈ¬№КҰФДж(NO)ЈҪ2ҰФХэ(O2)ЛөГчөҪҙпЖҪәвЈ»
d.·ҙУҰ»мәПЖшМеөДЦКБҝІ»ұдЈ¬ИЭЖчөДМе»эІ»ұдЈ¬ГЬ¶ИКјЦХІ»ұдЈ¬№КИЭЖчДЪОпЦКөДГЬ¶ИұЈіЦІ»ұдЈ¬І»ДЬЛөГчөҪҙпЖҪәвЈ»
№Кҙр°ёОӘbcЎЈ


 ҝОМГИ«ҪвЧЦҙКҫд¶ОЖӘХВПөБРҙр°ё
ҝОМГИ«ҪвЧЦҙКҫд¶ОЖӘХВПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝіЈОВПВЈ¬Ҫ«NaOHИЬТәөОИл¶юФӘИхЛбH2XИЬТәЦРЈ¬»мәПИЬТәЦРөДБЈЧУЕЁ¶ИУлИЬТәpHөДұд»Ҝ№ШПөИзПВНјЛщКҫЎЈПВБРРрКцХэИ·өДКЗЈЁ Ј©
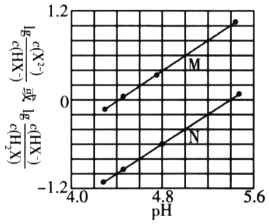
A. ЗъПЯMұнКҫ![]() УлpHөДұд»Ҝ№ШПө
УлpHөДұд»Ҝ№ШПө
B. NaHXИЬТәПФјоРФ
C. өұ»мәПИЬТәіКЦРРФКұЈ¬![]()
D. ![]() өДКэБҝј¶ОӘ
өДКэБҝј¶ОӘ![]()
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝВИ¶ЎПрҪәMКЗАнПлөДөзПЯөзАВІДБПЈ¬№ӨТөЙПҝЙУЙУР»ъ»Ҝ№ӨФӯБПA»тEЦЖөГЈ¬ЖдәПіЙВ·ПЯИзПВНјЛщКҫЎЈ

НкіЙПВБРМоҝХЈә
ЈЁ1Ј©AөДГыіЖКЗ_______Ј¬·ҙУҰўЫөД·ҙУҰАаРНКЗ_____ЎЈ
ЈЁ2Ј©Рҙіц·ҙУҰўЪөД»ҜС§·ҙУҰ·ҪіМКҪ_____ЎЈ
ЈЁ3Ј©ОӘСРҫҝОпЦКөД·јПгРФЈ¬Ҫ«EИэҫЫЎўЛДҫЫіЙ»·Чҙ»ҜәПОпЈ¬РҙіцЛьГЗөДҪб№№јтКҪ_____ЎЈјшұрХвБҪёц»·Чҙ»ҜәПОпөДКФјБОӘ_______ЎЈ
ЈЁ4Ј©ТФПВКЗУЙAЦЖұё№ӨіМЛЬБПPBөДФӯБПЦ®Т»1,4-¶Ў¶юҙј(BDO)өДәПіЙВ·ПЯЈә
![]()
РҙіцЙПКцУЙAЦЖұёBDOөД»ҜС§·ҙУҰ·ҪіМКҪ__________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝКөСйКТРиТӘ480mL0.2molЎӨL-1өДЗвСх»ҜДЖИЬТәЈ¬ПВБРЛө·ЁХэИ·өДКЗЈЁ Ј©
A.УГНРЕММмЖҪіЖИЎ3.8gNaOH№ММе
B.ИфЖдЛыІЩЧчХэИ·Ј¬Ҫ«NaOH№ММе·ЕФЪЙХұӯЦРИЬҪвәуЈ¬БўјҙЧӘТЖЦБИЭБҝЖҝЦР¶ЁИЭЈ¬ЛщөГИЬЦКОпЦКөДБҝЕЁ¶ИЖ«ҙу
C.ИфЖдЛыІЩЧчХэИ·Ј¬¶ЁИЭТЎФИәуЈ¬ИЬТә°јТәГжЧоөНөгөНУЪҝМ¶ИПЯЈ¬УГҪәН·өО№ЬјУЛ®ЦБҝМ¶ИПЯЈ¬ЛщөГИЬЦКОпЦКөДБҝЕЁ¶ИЖ«ҙу
D.УГ0.8molЎӨL-112mLNaOHИЬТәПЎКНіЙ480mLјҙҝЙ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЗвЖшөДДҰ¶ыЦКБҝОӘM gЎӨmolЈӯ1Ј¬ГЬ¶ИКЗҰС gЎӨLЈӯ1Ј¬°ў·ьјУөВВЮіЈКэОӘNAЈ¬ФтПВБРұнКцХэИ·өДКЗ
A.өҘО»Ме»эЦРЛщә¬ЗвЖш·ЦЧУКэДҝ![]()
B.өҘО»ЦКБҝЦРЛщә¬ЗвЖш·ЦЧУКэДҝОӘҰСЎӨNA
C.өҘёцЗвЖш·ЦЧУөДЦКБҝОӘ![]() g
g
D.өҘёцЗвЖш·ЦЧУХјУРөДМе»эОӘ![]() L
L
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЛХБӘҝЖС§јТЕ·°НБЦҪМКЪФЪЖдЦшЧчЦРФшЛөЈәЎ°ЙъГьЖрФҙУЪјЧНйЎұЈ¬Уў№ъҝЖС§јТ°НДЙ¶ыҪМКЪФтИПОӘЙъГьКЗҙУ¶юСх»ҜМјәНЛ®ҝӘКјөДЎЈУлЦ®Па№ШөДЧӘ»Ҝ№ШПөИзНјЛщКҫ(Іҝ·Ц·ҙУҰМхјюТСВФИҘ):

(1)AөДҪб№№КҪОӘ________Ј»CЦР№ЩДЬНЕөДөзЧУКҪОӘ________Ј»·ҙУҰўЪөД·ҙУҰАаРНОӘ________ЎЈ
(2)РҙіцПВБРОпЦКөДҪб№№јтКҪЈәD________Ј»H________ЎЈ
(3)CЎъDөД»ҜС§·ҪіМКҪОӘ__________Ј»¶юСх»ҜМјәНЛ®ҫӯ№вәПЧчУГЙъіЙЖПМСМЗөД»ҜС§·ҪіМКҪОӘ_________ЎЈ
(4)ФЪЧФИ»ҪзЦРПЛО¬ЛШУлЛ®ҝЙФЪјЧНйҫъөДҙЯ»ҜЧчУГПВЙъіЙјЧНйәН¶юСх»ҜМјЈ¬РҙіцёГ·ҙУҰөД»ҜС§·ҪіМКҪІўЕдЖҪЈә
_____ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝҫЭ№«°ІІҝ2019Дк12ФВНіјЖЈ¬2019ДкИ«№ъ»ъ¶ҜіөұЈУРБҝТСҙп3.5ТЪЎЈЖыіөОІЖшЕЕ·ЕөДМјЗв»ҜәПОпЎўөӘСх»ҜОпј°Т»Сх»ҜМјКЗРн¶аіЗКРҙуЖшОЫИҫөДЦчТӘОЫИҫОпЎЈөӘөД»ҜәПОпәПіЙЎўУҰУГј°өӘөД№М¶ЁТ»ЦұКЗҝЖС§СРҫҝөДИИөгЎЈ
I: (1)ТФCO2УлNH3ОӘФӯБПәПіЙ»Ҝ·КДтЛШөДЦчТӘ·ҙУҰИзПВЈә
ўЩ2NH3(g)Ј«CO2(g)ЈҪNH2CO2NH4(s)Ј»ҰӨH1ЈҪЈӯ159.47 kJЎӨmol1
ўЪNH2CO2NH4(s)ЈҪCO(NH2)2(s)Ј«H2O(g)Ј»ҰӨH2ЈҪa kJЎӨmol1
ўЫ2NH3(g)Ј«CO2(g)ЈҪCO(NH2)2(s)Ј«H2O(g)Ј»ҰӨH3ЈҪЈӯ86.98 kJЎӨmol1
ФтaОӘ______ЎЈ
(2)ДтЛШҝЙУГУЪКӘ·ЁСМЖшНСөӘ№ӨТХЈ¬Жд·ҙУҰФӯАнОӘЈәNOЈ«NO2Ј«H2OЈҪ2HNO2Ј»2HNO2Ј«CO(NH2)2ЈҪ2N2ЎьЈ«CO2ЎьЈ«3H2OЎЈ
ўЩөұСМЖшЦРNOЎўNO2°ҙЙПКц·ҙУҰЦРПөКэұИКұНСөӘР§№ыЧојСЎЈИфСМЖшЦРV(NO)ЎГV(NO2)ЈҪ5ЎГ1КұЈ¬ҝЙНЁИлТ»¶ЁБҝөДҝХЖшЈ¬Н¬ОВН¬С№ПВЈ¬V(ҝХЖш)ЎГV(NO)ЈҪ______(ҝХЖшЦРСхЖшөДМе»эә¬БҝҙуФјОӘ20%)ЎЈ
ўЪИзНј1ұнКҫДтЛШә¬Бҝ¶ФНСөӘР§ВКөДУ°ПмЈ¬ҙУҫӯјГТтЛШЙПҝјВЗЈ¬Т»°гСЎФсДтЛШЕЁ¶ИФјОӘ______%ЎЈ

(3)Нј2ұнКҫК№УГРВРНөзј«ІДБПЈ¬ТФN2ЎўH2ОӘөзј«·ҙУҰОпЈ¬ТФHCl-NH4ClОӘөзҪвЦКИЬТәЦЖФміцјИДЬМṩДЬБҝЈ¬Н¬КұУЦДЬКөПЦөӘ№М¶ЁөДРВРНИјБПөзіШЎЈЗлРҙіцёГөзіШөДХэј«·ҙУҰКҪ______Ј¬ЙъІъЦРҝЙ·ЦАліцөДОпЦКAөД»ҜС§КҪОӘ______ЎЈ
II: ПтИЭ»эОӘ2LөДГЬұХИЭЖчЦРјУИл»оРФМҝ![]() ЧгБҝ
ЧгБҝ![]() әНNOЈ¬·ўЙъ·ҙУҰ:
әНNOЈ¬·ўЙъ·ҙУҰ:![]()
![]()
![]() ЎчHЈј0Ј¬NOәН
ЎчHЈј0Ј¬NOәН![]() өДОпЦКөДБҝұд»ҜИзПВұнЛщКҫЎЈ
өДОпЦКөДБҝұд»ҜИзПВұнЛщКҫЎЈ
ОпЦКөДБҝ |
| T2/0C | |||||
0 |
|
|
|
|
|
| |
NO |
|
|
|
|
|
|
|
| 0 |
|
|
|
|
|
|
(1)T1ЎжОВ¶ИПВЈ¬·ҙУҰҪшРРБЛ![]() Ј¬УГ¶юСх»ҜМјұнКҫёГ·ҙУҰөДЖҪҫщ·ҙУҰЛЩВК
Ј¬УГ¶юСх»ҜМјұнКҫёГ·ҙУҰөДЖҪҫщ·ҙУҰЛЩВК![]() ______ЎЈТСЦӘЈәЖшМе·ЦС№
______ЎЈТСЦӘЈәЖшМе·ЦС№![]() ЖшМеЧЬС№
ЖшМеЧЬС№![]() Ме»э·ЦКэЎЈ
Ме»э·ЦКэЎЈ![]() КұУГЖҪәв·ЦС№ҙъМжЖҪәвЕЁ¶ИјЖЛгЖҪәвіЈКэ
КұУГЖҪәв·ЦС№ҙъМжЖҪәвЕЁ¶ИјЖЛгЖҪәвіЈКэ![]() ______ЎЈ
______ЎЈ
![]() өЪ
өЪ![]() әуЈ¬ОВ¶ИөчХыөҪ
әуЈ¬ОВ¶ИөчХыөҪ![]() Ј¬КэҫЭұд»ҜИзЙПұнЛщКҫЈ¬Фт
Ј¬КэҫЭұд»ҜИзЙПұнЛщКҫЈ¬Фт![]() ______
______![]() МоЎ°
МоЎ°![]() ЎұЎ°
ЎұЎ°![]() Ўұ»тЎ°
Ўұ»тЎ°![]() Ўұ
Ўұ![]() ЎЈ
ЎЈ
(3)Иф30minКұЈ¬ұЈіЦ![]() І»ұдЈ¬ПтёГИЭЖчЦРФЩјУИлёГЛДЦЦ·ҙУҰ»мәПОпёч
І»ұдЈ¬ПтёГИЭЖчЦРФЩјУИлёГЛДЦЦ·ҙУҰ»мәПОпёч![]() Ј¬ФтҙЛКұ·ҙУҰ______ТЖ¶Ҝ
Ј¬ФтҙЛКұ·ҙУҰ______ТЖ¶Ҝ![]() МоЎ°ХэПтЎұЎ°ДжПтЎұ»тЎ°І»Ўұ
МоЎ°ХэПтЎұЎ°ДжПтЎұ»тЎ°І»Ўұ![]() ЎЈ
ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝИЎ![]() ҫ«СЎВБНБҝу
ҫ«СЎВБНБҝу![]() Ц»ә¬
Ц»ә¬![]() Ўў
Ўў![]() әН
әН![]() Ј¬·ЫЛйәуН¶ИлөҪ100mLДіЕЁ¶ИөДNaOHИЬТәЦРЈ¬јУИИҪБ°иід·Ц·ҙУҰәу№эВЛЖъИҘІ»ИЬОпЈ¬ПтВЛТәЦРөОјУ
Ј¬·ЫЛйәуН¶ИлөҪ100mLДіЕЁ¶ИөДNaOHИЬТәЦРЈ¬јУИИҪБ°иід·Ц·ҙУҰәу№эВЛЖъИҘІ»ИЬОпЈ¬ПтВЛТәЦРөОјУ![]() өДПЎБтЛбЈ¬өұјУИлБтЛб
өДПЎБтЛбЈ¬өұјУИлБтЛб![]() КұҝӘКјіцПЦіБөнЈ¬өұјУИлБтЛб
КұҝӘКјіцПЦіБөнЈ¬өұјУИлБтЛб![]() КұҝӘКјіБөнөДБҝІ»ФЩұд»ҜЈ¬ФЩ№эВЛЈ¬Ҫ«іБөнПҙөУЧЖЙХәуЈ¬өГ№ММе
КұҝӘКјіБөнөДБҝІ»ФЩұд»ҜЈ¬ФЩ№эВЛЈ¬Ҫ«іБөнПҙөУЧЖЙХәуЈ¬өГ№ММе![]() ПВБРЛө·ЁІ»ХэИ·өДКЗ
ПВБРЛө·ЁІ»ХэИ·өДКЗ![]()
![]()
A.ёГВБНБҝуЦР![]() өДЦКБҝ·ЦКэОӘ
өДЦКБҝ·ЦКэОӘ![]()
B.ёГВБНБҝуЦР![]() өДЦКБҝ·ЦКэОӘ
өДЦКБҝ·ЦКэОӘ![]()
C.ЛщУГNaOHИЬТәөДОпЦКөДБҝЕЁ¶ИОӘ![]()
D.јУИлБтЛб![]() КұЈ¬іБөнБҝҙпЧоҙуЦө
КұЈ¬іБөнБҝҙпЧоҙуЦө
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝCaC2ҫ§МеөДҫ§°ыҪб№№УлNaClҫ§МеөДПаЛЖЈЁИзНјЛщКҫЈ©Ј¬ө«CaC2ҫ§МеЦРә¬УРСЖБеРОөД![]() Ј¬К№ҫ§°ыСШТ»ёц·ҪПтАӯіӨЎЈПВБР№ШУЪCaC2ҫ§МеөДЛө·ЁХэИ·өДКЗЈЁ Ј©
Ј¬К№ҫ§°ыСШТ»ёц·ҪПтАӯіӨЎЈПВБР№ШУЪCaC2ҫ§МеөДЛө·ЁХэИ·өДКЗЈЁ Ј©

A.ГҝёцCa2+ЦЬО§ҫаАлЧоҪьЗТПаөИөД![]() өДКэДҝОӘ6
өДКэДҝОӘ6
B.ёГҫ§МеЦРөДТхАлЧУУлF2КЗөИөзЧУМе
C.6.4g CaC2ҫ§МеЦРә¬УР0.1molТхАлЧУ
D.ГҝёцCa2+ЦЬО§ҫаАлЧоҪьЗТПаөИөДCa2+УР12ёц
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com