
【题目】氢气的摩尔质量为M g·mol-1,密度是ρ g·L-1,阿伏加德罗常数为NA,则下列表述正确的是
A.单位体积中所含氢气分子数目![]()
B.单位质量中所含氢气分子数目为ρ·NA
C.单个氢气分子的质量为![]() g
g
D.单个氢气分子占有的体积为![]() L
L
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】pH=13的两种碱溶液M、N各1mL,分别加水稀释到1000mL,其pH与溶液体积(V/mL)的关系如图所示,下列说法正确的是( )
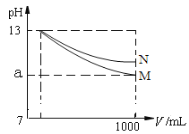
A.M、N两种碱溶液的物质的量浓度一定相等
B.稀释后,M溶液的碱性比N溶液强
C.若10<a<13,则M、N都是弱碱
D.若a=10,则M是强碱,N不一定是弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构简式如图所示。下列叙述正确的是( )

A. 迷迭香酸与溴单质只能发生取代反应
B. 1 mol迷迭香酸最多能和9 mol氢气发生加成反应
C. 迷迭香酸可以发生水解反应、取代反应和酯化反应
D. 1 mol迷迭香酸最多能和5 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为2K2S2+KI3![]() K2S4+3KI;装置(Ⅱ)为电解池的示意图,当闭合开关K时,X附近溶液先变红。则下列说法正确的是
K2S4+3KI;装置(Ⅱ)为电解池的示意图,当闭合开关K时,X附近溶液先变红。则下列说法正确的是![]() ( )
( )
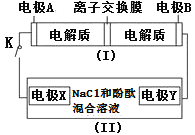
A.闭合K时,K+从左到右通过离子交换膜
B.闭合K时,电极X是阳极
C.闭合K时,电极A的反应式为3I--2e-=I3-
D.闭合K时,当有0.1molK+通过离子交换膜,X电极上产生气体2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 在一定条件下与
在一定条件下与![]() 反应转化为甲醇
反应转化为甲醇![]() 是变废为宝的好方法,一定条件下,每转化
是变废为宝的好方法,一定条件下,每转化![]() 放出的热量为
放出的热量为![]() ,
,![]() 转化为甲醇过程中浓度随时间的变化曲线如图所示
转化为甲醇过程中浓度随时间的变化曲线如图所示![]() 已知反应物和生成物在此条件下均为气体
已知反应物和生成物在此条件下均为气体![]() ,下列叙述中正确的是
,下列叙述中正确的是

A.在进行到3分钟时,![]() 和
和![]() 所表达的反应速率值相等,均为
所表达的反应速率值相等,均为![]()
B.此反应的热化学方程式为:![]()
C.此条件下反应的平衡常数为![]()
D.降低温度,此反应的平衡常数可能为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)D﹣的结构示意图是___。
(2)C元素的气态氢化物的化学式为:___;其检验方法:___。
(3)B元素在周期表中的位置___;离子半径:B___A(填“大于”或“小于”)。
(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为___,与D的氢化物的水化物反应的离子方程式为___。
II.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(1)NO的平衡浓度c/span>(NO)=___。
(2)图中表示NO2变化的曲线是___,用O2表示0~2s内该反应的平均速率υ=___。
(3)能说明该反应已达到平衡状态的是___。
a.υ(NO2)=2υ(O2) b.容器内气体压强保持不变
c.υ逆(NO)=2υ正(O2) d.容器内气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒的新药。合成丁苯酞(J)的一种路线如图:

已知:R-Br![]() RMgBr
RMgBr
(1)A的名称是______,A分子中最多有_____个原子共平面。
(2)D生成E的反应类型为_________。
(3)F的结构简式_________。
(4)J是一种酯,分子中除苯环外还含有一个五元环。写出H生成J的化学方程式_____(注明反应条件)。
(5)E![]()
![]() X,X的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X的同分异构体共有______种。
X,X的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X的同分异构体共有______种。
(6)利用题中信息和所学知识,写出以甲烷和化合物D为原料,合成 ![]() 的路线流程图_______(其它试剂自选)。
的路线流程图_______(其它试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应:A(g)![]() B(g)+C(g),在温度为3 00K时,向2.0L恒容密闭容器中充入1.0mol A,反应过程中测得的B物质的物质的量随时间的变化关系如图,下列说法不正确的是
B(g)+C(g),在温度为3 00K时,向2.0L恒容密闭容器中充入1.0mol A,反应过程中测得的B物质的物质的量随时间的变化关系如图,下列说法不正确的是
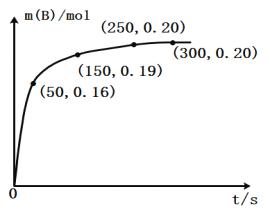
A.0~50秒,A物质化学反应速率v(A)=0.0016mo1·L-1·s-1
B.250s时该反应达到化学平衡状态
C.若改加入2.0mol A,A的平衡转化率大于20%
D.300K时,该反应的平衡常数为0.025 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.研究表明: CO2和 CO可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)枯竭危机。
(1)目前工业上有一种方法是用 CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例,该过程分两步进行:
反应 I: CO2(g)+H2(g)![]() CO(g)+ H2O(g) △H =+41.3kJ·mol -1
CO(g)+ H2O(g) △H =+41.3kJ·mol -1
反 应 II: 2CO(g)+ 4H2(g) ![]() C2H4(g) +2H2O(g) △H =-210.5kJ·mol -1
C2H4(g) +2H2O(g) △H =-210.5kJ·mol -1
①CO2加氢合成乙烯的热化学方程式为_____。
②一定条件下的密闭容器中,上述反应 I 达到平衡后,要加快反应速率并提高 CO2 的转化率,可以采取的措施是_____(填字母)。
A.减小压强
B 分离出水蒸气.
C.加入适当催化剂
D.增大 H2浓度
E.升高温度
(2)将不同物质的量的H2O(g)和 CO(g)分别通入体积为 2 L 的恒容密闭容器中,进行反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/ mol | 平衡量/ mol | 达到平衡所 需时间/min | ||
H2O | CO | CO | H2 | |||
Ⅰ | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
Ⅱ | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
Ⅲ | 900 | a | b | c | d | t |
若 a=2,b=1,则 c=_____,达到平衡时实验组Ⅱ中 H2O(g)和实验组Ⅲ中 CO的转化率的关系为 αⅡ(H2O)_____(填“<”“>”或“=”)αⅢ(CO)。
(3)可以用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),已知一定条件下,该反应中 CO 的平衡转化率随温度、投料比 n(H2)/ n(CO)的变化曲线如图所示。
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中 CO 的平衡转化率随温度、投料比 n(H2)/ n(CO)的变化曲线如图所示。
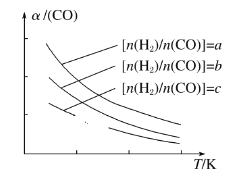
①a、b、c 按从大到小的顺序排序为_____
②根据图像可以判断该反应为放热反应,理由是_________________
(4)工业上还可利用 CO或 CO2来生产燃料甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2 | K2 | 1.0 | 2.50 |
③3H2(g)+CO2 | K3 | ||
据反应①与②可推导出 K1、K2 与 K3之间的关系,则 K3=_____(用 K1、K2 表示); 反应③的ΔH_____(填“>”或“<”)0。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com