
【题目】如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为2K2S2+KI3![]() K2S4+3KI;装置(Ⅱ)为电解池的示意图,当闭合开关K时,X附近溶液先变红。则下列说法正确的是
K2S4+3KI;装置(Ⅱ)为电解池的示意图,当闭合开关K时,X附近溶液先变红。则下列说法正确的是![]() ( )
( )
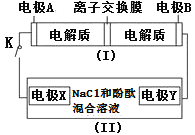
A.闭合K时,K+从左到右通过离子交换膜
B.闭合K时,电极X是阳极
C.闭合K时,电极A的反应式为3I--2e-=I3-
D.闭合K时,当有0.1molK+通过离子交换膜,X电极上产生气体2.24L
【答案】A
【解析】
当闭合开关K时,X附近溶液先变红,说明X极生成OH-,应为电解池的阴极,发生反应为:2H2O+2e-=H2↑+2OH-,Y为电解池的阳极,发生:2Cl--2e-=Cl2↑,则A为原电池的负极,电极反应式为2K2S2-2e-=K2S4+2K+,B为原电池的正极,电极反应式为I3-+2e-=3I-。
A. 原电池工作时,阳离子向正极移动,应从左到右通过离子交换膜,故A正确;
B. 当闭合开关K时,X附近溶液先变红,说明X极生成OH-,应为电解池的阴极,故B错误;
C. X为电解池的阴极,发生反应为:2H2O+2e-=H2↑+2OH-,故C错误;
D. 当有0.1molK+通过离子交换膜,即当电极Y有0.1mole-转移时,根据2H++2e-=H2↑知产生0.05molH2,标况下的体积是1.12L,题中没有给定气体的存在状态,不能确定气体的体积一定为11.2L,故D错误;
故选:A。


科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.0100mol/L苯酚(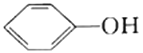 )溶液中滴加0.0100mol/LNaOH溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法正确的是
)溶液中滴加0.0100mol/LNaOH溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法正确的是
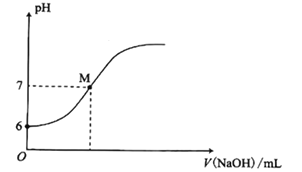
A. 25℃时,苯酚的电离常数Ka约为1.0×10-4
B. M点时,所加人NaOH溶液的体积大于10mL
C. M点时,溶液中的水不发生电离
D. 加入20mLNaOH溶液时,溶液中c(OH-)-c(H+)=2c(Na+)-2c(![]() )-c(
)-c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对可逆反应:2NO2 (g)![]() 2NO(g) +O2 (g)ΔH=- 1162kJ·mol-1 的影响,若保持气体的总质量不变,在温度为 T1、T2 时,通过实验得到平衡体系中 NO 体积分数随压强的变化曲线,实验结果如图所示。下列说法正确的是
2NO(g) +O2 (g)ΔH=- 1162kJ·mol-1 的影响,若保持气体的总质量不变,在温度为 T1、T2 时,通过实验得到平衡体系中 NO 体积分数随压强的变化曲线,实验结果如图所示。下列说法正确的是

A.a、c 两点混合气体的平均相对分子质量:Ma>Mc
B.b、c 两点的平衡常数:Kb=Kc
C.从状态a 到状态c,NO2 气体的转化率减小
D.T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯丁橡胶M是理想的电线电缆材料,工业上可由有机化工原料A或E制得,其合成路线如下图所示。

完成下列填空:
(1)A的名称是_______,反应③的反应类型是_____。
(2)写出反应②的化学反应方程式_____。
(3)为研究物质的芳香性,将E三聚、四聚成环状化合物,写出它们的结构简式_____。鉴别这两个环状化合物的试剂为_______。
(4)以下是由A制备工程塑料PB的原料之一1,4-丁二醇(BDO)的合成路线:
![]()
写出上述由A制备BDO的化学反应方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升。下列分析错误的是

A.Al和O2化合放出热量B.硝酸汞是催化剂
C.涉及了:2Al+3Hg2+→2Al3++3HgD.“白毛”是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要480mL0.2mol·L-1的氢氧化钠溶液,下列说法正确的是( )
A.用托盘天平称取3.8gNaOH固体
B.若其他操作正确,将NaOH固体放在烧杯中溶解后,立即转移至容量瓶中定容,所得溶质物质的量浓度偏大
C.若其他操作正确,定容摇匀后,溶液凹液面最低点低于刻度线,用胶头滴管加水至刻度线,所得溶质物质的量浓度偏大
D.用0.8mol·L-112mLNaOH溶液稀释成480mL即可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气的摩尔质量为M g·mol-1,密度是ρ g·L-1,阿伏加德罗常数为NA,则下列表述正确的是
A.单位体积中所含氢气分子数目![]()
B.单位质量中所含氢气分子数目为ρ·NA
C.单个氢气分子的质量为![]() g
g
D.单个氢气分子占有的体积为![]() L
L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及一氧化碳是许多城市大气污染的主要污染物。氮的化合物合成、应用及氮的固定一直是科学研究的热点。
I: (1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH1=-159.47 kJ·mol1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH2=a kJ·mol1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH3=-86.98 kJ·mol1
则a为______。
(2)尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=______(空气中氧气的体积含量大约为20%)。
②如图1表示尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为______%。

(3)图2表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式______,生产中可分离出的物质A的化学式为______。
II: 向容积为2L的密闭容器中加入活性炭![]() 足量
足量![]() 和NO,发生反应:
和NO,发生反应:![]()
![]()
![]() △H<0,NO和
△H<0,NO和![]() 的物质的量变化如下表所示。
的物质的量变化如下表所示。
物质的量 |
| T2/0C | |||||
0 |
|
|
|
|
|
| |
NO |
|
|
|
|
|
|
|
| 0 |
|
|
|
|
|
|
(1)T1℃温度下,反应进行了![]() ,用二氧化碳表示该反应的平均反应速率
,用二氧化碳表示该反应的平均反应速率![]() ______。已知:气体分压
______。已知:气体分压![]() 气体总压
气体总压![]() 体积分数。
体积分数。![]() 时用平衡分压代替平衡浓度计算平衡常数
时用平衡分压代替平衡浓度计算平衡常数![]() ______。
______。
![]() 第
第![]() 后,温度调整到
后,温度调整到![]() ,数据变化如上表所示,则
,数据变化如上表所示,则![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
(3)若30min时,保持![]() 不变,向该容器中再加入该四种反应混合物各
不变,向该容器中再加入该四种反应混合物各![]() ,则此时反应______移动
,则此时反应______移动![]() 填“正向”“逆向”或“不”
填“正向”“逆向”或“不”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有NH4+、K+、Al3+、SO42ˉ四种离子,进行如下实验:
(1)取10 mL该溶液于试管中并滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03 mol白色沉淀;
(2)取10 mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体(必要时可加热),最后沉淀完全溶解。并且随NaOH溶液的加入,沉淀和气体的变化关系如下图所示。
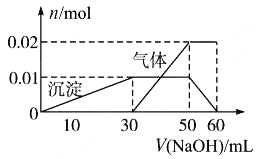
下列说法不符合事实的是( )
A. 根据图所示数据计算实验中使用的NaOH溶液的物质的量浓度为1mol/L
B. 根据信息分析该溶液中焰色反应呈现紫色的离子的物质的量浓度为1mol/L
C. 另取一定量该溶液滴加一定量的Ba(OH)2溶液,能使Al3+和SO42ˉ同时完全沉淀
D. NH4+、K+、Al3+、SO42ˉ四种离子的物质的量之比为:2:1:1:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com