
【题目】在化学课上围绕浓硫酸的化学性质进行了如下实验探究,将适量的蔗糖放入烧杯中,加入少量水,搅拌均匀,然后加入浓硫酸,快速搅拌,生成疏松多孔的黑色物质。
(1) 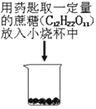 (2)
(2) 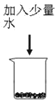 (3)
(3) 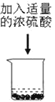 (4)
(4) 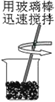 (5)
(5) 
请回答下列问题:
①根据上述实验步骤(1)-(5)中,蔗糖与浓硫酸反应的实验现象,浓硫酸表现出的化学性质有____________ (填字母)。
A.酸性 B.吸水性 C.脱水性 D.强氧化性
②反应中生成的黑色物质继续与浓硫酸作用,产生两种气体,其中一种气体 X 有刺激性气味,另一种气体 Y 无色无味,写出反应的化学方程式_____________。
③为了在混合气体中检验出 X、Y 这两种气体,提供下列试剂:(试剂可多次使用,不考虑尾气处理)
A.品红溶液 B.澄清石灰水 C.酸性高锰酸钾溶液 D.氢氧化钠溶液
气体通过的顺序依次是:____________→____________→____________→____________ (填字母)。证明有气体 Y 存在的实验现象为____________。
【答案】BCD C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O A C A B 澄清石灰水变浑浊
【解析】
浓硫酸溶于水放出大量的热,蔗糖脱水生成碳,生成的碳与浓硫酸反应生成二氧化碳、二氧化硫和水;混合气体的成分是是二氧化碳和二氧化硫,先检验二氧化硫,再检验二氧化碳。
(1)①将适量的蔗糖放入烧杯中,加入少量水,然后加入浓硫酸,生成黑色物质碳表现了浓硫酸的脱水性,浓硫酸吸收水放出大量的热,碳与浓硫酸在加热的条件下反应,生成两种气体,体现了浓硫酸的吸水性和强氧化性;
②黑色物质继续与浓硫酸作用,产生两种气体,其中一种气体 X 有刺激性气味,是大气的污染物之一,这种刺激性气味的气体是SO2,另一种无色无味气体Y是CO2,反应的化学方程式为:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O;
③先将混合气体通入品红溶液检验二氧化硫,品红溶液褪色,含有二氧化硫,从品红溶液中出来的气体通入酸性高锰酸钾溶液,酸性高锰酸钾溶液颜色变浅,这一步除去二氧化硫,通过酸性高锰酸钾溶液出来的气体再通入品红溶液,品红溶液不变色,证明二氧化硫除尽,再通入澄清石灰水,若有白色沉淀生成,则含有二氧化碳。故气体通过的顺序依次是:A→C→A→B;


科目:高中化学 来源: 题型:
【题目】绿矾是含有一定结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
Ⅰ.为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。
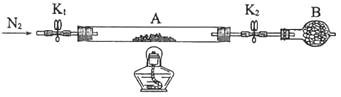
(1)仪器B的名称是______。
(2)将下列实验操作步骤正确排序______(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量A
f.持续通氮气,冷却至室温
(3)根据实验记录,计算绿矾化学式中结晶水数目x=______(列式表示)。
Ⅱ.已知某些硫酸盐受热易分解为相应的氧化物,为探究硫酸亚铁的分解产物,将实验Ⅰ中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红棕色粉末。
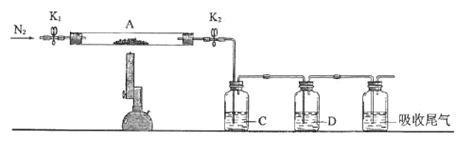
(4)C中盛放BaCl2溶液,并在实验中观察到有白色沉淀生成,其作用为:______。
(5)D中盛放的溶液为______(填标号)。
a.品红 b.NaOH c.Ba(NO3)2 e.浓H2SO4
(6)写出硫酸亚铁高温分解反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列各组物质性质的比较,结论正确的是(____________)
A. 分子的极性:![]() B. 物质的硬度:
B. 物质的硬度:![]()
C. 物质的沸点:![]() D.在
D.在![]() 中的溶解度:
中的溶解度:![]()
Ⅱ.锰单质及其化合物应用十分广泛。回答下列问题:

(1)![]() 位于元素周期表中第四周期____族,基态
位于元素周期表中第四周期____族,基态![]() 原子核外未成对电子有_____个。
原子核外未成对电子有_____个。
(2)![]() 可与
可与![]() 反应生成
反应生成![]() ,新生成的化学键为_____键。
,新生成的化学键为_____键。![]() 分子的空间构型为______,其中N原子的杂化轨道类型为_______。
分子的空间构型为______,其中N原子的杂化轨道类型为_______。
(3)金属锰有多种晶型,其中![]() 的结构为体心立方堆积,晶胞参数为apm,
的结构为体心立方堆积,晶胞参数为apm, ![]() 中锰的原子半径为_____pm。已知阿伏加德罗常数的值为
中锰的原子半径为_____pm。已知阿伏加德罗常数的值为![]() ,
, ![]() 的理论密度
的理论密度![]() ____
____![]() 。(列出计算式)
。(列出计算式)
(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为____,其配位数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是( )
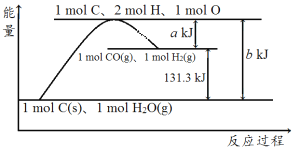
A.反应的热化学方程式可表示为C(s)+H2O(g)=CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B.该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C.amol C和amol H2O(l)反应生成amol CO和a mol H2吸收的热量一定为131.3a kJ
D.1mol C、2mol H、1mol O转变成1mol CO(g)和1mol H2(g)放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pK=-lgK,25℃时,二元酸H2A的pK1=1.85,pK2=7.19。25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是

A. a点所得溶液中:Vo=10mL
B. C点所得溶液中:c(A2-)=c(HA-)
C. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. d点所得溶液中:A2-的水解平衡常数K1=1×10-7.19
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化铬(CrO3)又叫铬酸酐,是一种暗红色固体,溶于水会生成铬酸(H2CrO4),200℃以上会部分分解生成氧化铬(Cr2O3)。
I.下图是用铬铁矿(主要成分是FeCr2O4,含A12O3、SiO2等杂质)生产CrO3的传统工艺流程,请回答相关问题。
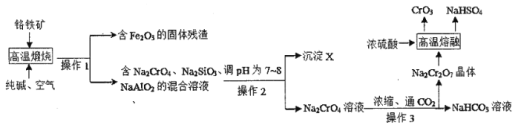
(1)操作1的名称是____,沉淀X的成分是_____(填化学式)。
(2)高温煅烧时FeCr2O4参与反应的化学方程式是____。
II.某工厂采用了一种新的生产CrO3的工艺流程,与传统工艺流程主要区别如下图所示(中间过程省略)。
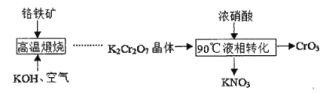
(3)液相转化过程发生反应的化学方程式是____。
(4)新工艺与传统工艺相比有多种优点:可得到价值更高的副产品KNO3;___;从绿色化学角度考虑新工艺也存在某种缺点,该缺点是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称取14.2 g 无水硫酸钠固体(摩尔质量为142 g/mol)溶于适量水中,再稀释至100 mL。回答下列问题:
(1)从配制所得的溶液中取出50 mL,该50 mL的溶液中硫酸钠的物质的量浓度为:___________
(2)写出硫酸钠在水溶液中的电离方程式:________。
(3)14.2 g该固体中含有钠离子的数目是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能大量共存,Al3++3OH-=Al(OH)3↓ |
B | 由水电离出的H+浓度为1×10-12molL-1 |
| 一定能大量共存
|
C | pH=1的溶液 | Fe2+、Al3+、 | 不能大量共存,5Fe2++ |
D | 通入少量SO2气体 | K+、Na+、ClO-、 | 不能大量共存,2ClO-+SO2+H2O=2HClO+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假设12C的相对原子质量为24,如果以0.024 kg12C所含的原子数为阿伏加德罗常数,下列数值中肯定不变的是( )
A.氢气的摩尔质量
B.16 g氧气所含的分子数
C.氧气的相对分子质量
D.一定条件下,跟2 g氢气相化合的氧气的物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com