
【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能大量共存,Al3++3OH-=Al(OH)3↓ |
B | 由水电离出的H+浓度为1×10-12molL-1 |
| 一定能大量共存
|
C | pH=1的溶液 | Fe2+、Al3+、 | 不能大量共存,5Fe2++ |
D | 通入少量SO2气体 | K+、Na+、ClO-、 | 不能大量共存,2ClO-+SO2+H2O=2HClO+ |
A.AB.BC.CD.D
【答案】C
【解析】
A.离子之间不发生任何反应,可大量共存,但加入氨水生成沉淀,由于一水合氨为弱电解质,发生Al3++3NH3·H2O═Al(OH)3↓+3NH4+,故A错误;
B.由水电离出的H+浓度为1×10-12mol·L-1,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性,碱性条件下NH4+不能大量共存,故B错误;
C.pH=1的溶液呈酸性,酸性条件下Fe2+与MnO4-发生氧化还原反应,反应的离子方程式为5Fe2++MnO4-+8H+═Mn2++5Fe3++4H2O,故C正确;
D.SO2具有还原性,与ClO-发生氧化还原反应,反应的离子方程式为ClO-+SO2+H2O═2H++Cl-+SO42-,故D错误。
故选:C。


科目:高中化学 来源: 题型:
【题目】关于氯水成分的实验,请回答以下问题:
(1)将足量氯气溶于水制成的饱和氯水呈_______色,说明氯水中含有_______分子。
(2)向氯水中滴加稀硝酸酸化的硝酸银溶液产生的现象是_______,说明氯水中还存在的粒子是_______。
(3)向氯水中加入少量Na2CO3溶液,发现有气泡产生,说明氯水中含有_______;将新制氯水滴加到蓝色石蕊试纸上产生的现象是_______,说明新制氯水中还存在的粒子是_______;由于_______见光易分解,因此氯水需保存在棕色试剂瓶中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学课上围绕浓硫酸的化学性质进行了如下实验探究,将适量的蔗糖放入烧杯中,加入少量水,搅拌均匀,然后加入浓硫酸,快速搅拌,生成疏松多孔的黑色物质。
(1) 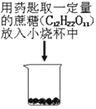 (2)
(2) 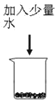 (3)
(3) 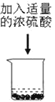 (4)
(4) 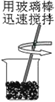 (5)
(5) 
请回答下列问题:
①根据上述实验步骤(1)-(5)中,蔗糖与浓硫酸反应的实验现象,浓硫酸表现出的化学性质有____________ (填字母)。
A.酸性 B.吸水性 C.脱水性 D.强氧化性
②反应中生成的黑色物质继续与浓硫酸作用,产生两种气体,其中一种气体 X 有刺激性气味,另一种气体 Y 无色无味,写出反应的化学方程式_____________。
③为了在混合气体中检验出 X、Y 这两种气体,提供下列试剂:(试剂可多次使用,不考虑尾气处理)
A.品红溶液 B.澄清石灰水 C.酸性高锰酸钾溶液 D.氢氧化钠溶液
气体通过的顺序依次是:____________→____________→____________→____________ (填字母)。证明有气体 Y 存在的实验现象为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是( )
A.向![]() 溶液中滴入用硫酸酸化的
溶液中滴入用硫酸酸化的![]() 溶液,溶液变黄,说明发生氧化还原反应,且氧化性:
溶液,溶液变黄,说明发生氧化还原反应,且氧化性:![]()
B.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
C.制备氢氧化铁胶体通常是将饱和氯化铁溶液煮沸,直至呈红褐色,停止加热
D.在饱和![]() 溶液中加入一定量
溶液中加入一定量![]() ,充分反应后恢复到原温度,有晶体析出,溶液质量不变
,充分反应后恢复到原温度,有晶体析出,溶液质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术大学的钱逸泰教授等以![]() 和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物,该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。下列有关说法中,你认为错误的是( )
和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物,该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。下列有关说法中,你认为错误的是( )
A.![]() 的还原性强于金刚石B.另一种化合物是
的还原性强于金刚石B.另一种化合物是![]()
C.纳米级金刚石粉末可以透过半透膜D.这个反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质的结构与性质)
钛有“生物金属”和“未来金属”之称,钛及其化合物的应用正越来越受到人们的关注。
(1)基态钛原子外围电子的轨道表达式为___________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有___种。
(2)金属钛的熔点、硬度均比铝大,可能的原因是____。
(3)TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离TiCl4和SiCl4的混合物,先获得的馏分是__________ (填化学式)。

(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图所示。
①组成该物质的元素中,电负性最大的是__________ (填元素名称)。
②M中碳原子的杂化形式有___________种。
③M中不含__________ (填字母代号)。
a.π键 b.σ键 c.配位键
d.氢键 e.离子键

(5)①金属钛晶体中原子采用面心立方最密堆积,则晶胞中钛原子的配位数为_____。
②设钛原子的直径为d cm,用NA表示阿伏加德罗常数的值,钛原子的摩尔质量为M g·mol-1,则晶体钛的密度为________g·cm-3。
③金属钛晶胞中有若干个正四面体空隙,如图中a、b、c、d四个钛原子形成一个正四面体,其内部为正四面体空隙,可以填充其他原子。若晶胞中所有的正四面体空隙中都填充氢原子,那么形成的氢化钛的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某一元弱酸HA的电离常数K=1.6×10-6。向20.00mL浓度约为0.1mol·L-1 HA溶液中逐滴加入0.1000mol·L-1的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
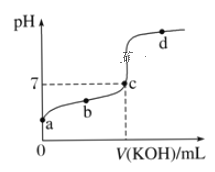
(1)a、b、c、d四点中水的电离程度最大的是_______点,滴定过程中宜选用__________作指示剂,滴定终点在__________(填“c点以上”或“c点以下”)。
(2)滴定过程中部分操作如下,下列各操作使测量结果偏高的是_____(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(3)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为_____mol/L。(保留4位有效数字)
实验序号 | NaOH溶液体积/mL | 待测HA溶液体积/mL |
1 | 21.01 | 20.00 |
2 | 20.99 | 20.00 |
3 | 21.60 | 20.00 |
(4)a点溶液中pH约为________,此时溶液中H2O电离出的c(H+)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(举一反三)下列说法正确的是( )
A.在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解
B.铜与浓硝酸反应的离子方程式为Cu+4H++2NO![]() ===Cu2++2NO2↑+2H2O
===Cu2++2NO2↑+2H2O
C.1.0 mol·L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO![]()
D.硫化铜溶于硝酸的离子方程式为CuS+2H+===H2S↑+Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的部分生成物和反应的条件没有标出)。
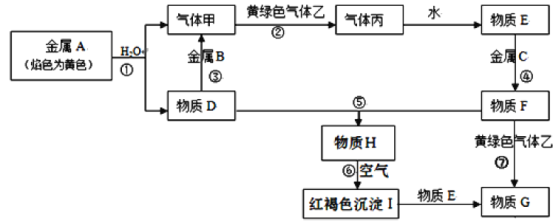
请回答下列问题:
【1】D、F、G的化学式分别是
A.NaOH、FeCl2、FeCl3B.NaOH、FeCl3、FeCl2
C.Fe3O4、FeCl2、FeCl3D.Fe3O4、FeCl3、FeCl2
【2】A、B、C的金属活动性顺序是
A.A>B>CB.A>C>BC.B>A>CD.C>B>A
【3】①~⑦反应中未涉及到四种基本反应类型中的
A.化合反应B.分解反应C.置换反应D.复分解反应
【4】除去F溶液中的少量G,常加入或通入足量的。
A.铁粉B.氯气C.双氧水D.酸性高锰酸钾溶液
【5】除去乙中的少量丙,常将混合气通入到中进行洗气。
A.NaOH溶液B.饱和食盐水C.饱和NaHCO3溶液D.浓硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com