
| A、CH3CH2Br+HS-→CH3CH2-HS+Br- |
| B、CH3CH2I+HS-→CH3CH2HS+I- |
| C、CH3Cl+CH3CH2S-→CH3SCH2CH3+Cl- |
| D、CH3Cl+HS-→CH3S-+HCl |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 原子结构或性质 | ||
| A | 原子最外层电子数是内层电子总数的
| ||
| B | 形成化合物种类最多的元素,其单质为固体 | ||
| C | 生活中用途最广泛的金属,它有两种常见的氯化物,且相对分子质量相差35.5 | ||
| D | 地壳中含量最多的元素 | ||
| E | 位于第三周期,且最外层电子数等于电子层数 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、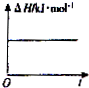 |
C、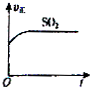 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、①③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
13 6 |
14 7 |
13 6 |
12 6 |
14 6 |
14 7 |
15 7 |
14 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气在氯气中燃烧发出苍白色火焰,在瓶口有白雾生成 |
| B、红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟,加入少量水形成蓝色溶液 |
| C、金属Na在氯气中燃烧产生淡黄色的烟 |
| D、红热的铁丝在氯气中燃烧产生红棕色的烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:
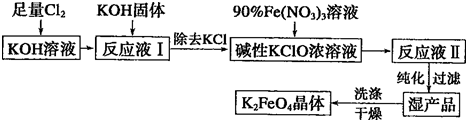

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com