
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题: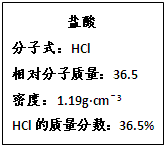
(1)该浓盐酸中HCl的物质的量浓度为___________。若用KMnO4。氧化上述HCl。其反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)1molKMnO4完全反应,反应后溶液的体积为2L,则所得产物中Cl-的物质的量浓度为____________。
(3)8molHCI完全反应,产生的Cl2在标准状况下的体积为_____________。
(8分)(1)11.9 mol/L(2分) (2)1.5mol/L (3分) (3)56L(3分)
解析试题分析:(1)根据c= 可知,该盐酸的浓度c=
可知,该盐酸的浓度c= mol/L=11.9mol/L.
mol/L=11.9mol/L.
(2)1mol KMnO4恰好和盐酸全部完全反应,则:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
2mol 2mol 2mol 5mol
1mol 1mol 1mol 2.5mol
则反应后溶液中Cl-的浓度=(1mol+1mol×2)÷2L=1.5mol/L
(3)生成氢气在标准状况下的体积为2.5mol×22.4L/mol=56L
考点:考查氧化还原反应和物质的量浓度的有关计算


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:填空题
将1.66g碳酸钠和氢氧化钠的固体混合物完全溶于水,配成稀溶液,然后向该溶液中逐滴加入1mo1/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示。
提示:Na2CO3与盐酸是分步进行的,第一步为Na2CO3+HCl=NaHCO3+NaCl;第二步为NaHCO3+HCl=NaCl+H2O+CO2↑。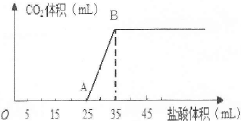
请回答下列问题:
(1)OA段是盐酸与Na2CO3和NaOH发生的反应,反应后溶液中的溶质有 (填化学式)。
(2)当到达B点时,产生CO2的体积为 mL(标准状况)。
(3)计算原混合物中Na2CO3的质量分数。(写出计算过程,结果保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
| 盐酸 分子式:HCl 相对分子质量:36.5,密度:1.19 g·cm-3 HCl的质量分数:36.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按要求完成下列填空:
(1)乙烯发生聚合反应的方程式为:
(2)苯的硝化反应的化学方程式为:
(3)乙醇在铜存在条件下催化氧化的方程式为:
(4)写出CH3C18O16OH与C2H518OH发生酯化反应的方程式::
(5)写出磁性氧化铁与铝粉发生反应的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
生态农业涉及农家肥料的综合利用,某种肥料经发酵得到一种含甲烷、CO2、氮气的混合气体2.016升(标准状况),该气体通过盛有红热CuO粉末的硬质玻璃管,发生反应:CH4+4CuO CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。
CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。
(1)原混合气体中CH4的物质的量为________mol;
(2)原混合气体中N2的体积分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表是学习和研究化学的重要工具。按要求回答下列问题:
A、B、C、D、E是短周期元素,其原子序数依次增大。A、C两元素的最外层只有一个电子,C离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同;元素A可以和B形成A2B和A2B2两种分子;化合物甲和乙的每个分子中均含有5个原子,甲是由元素D与A组成,其分子的核外电子总数为18,乙是由元素D与E组成;化合物丙是由C与E组成的。
(1)元素B、D、E的元素符号依次为_______、_______、______。
(2)上述5种元素形成的分子中,除甲分子外,核外电子总数也为18的有___(填分子式)
(3)D的氧化物在高温下可以与C的碳酸盐发生反应,其化学反应方程式为________;化合物乙遇水剧烈反应有白雾生成,其反应的化学方程式为___________。
(4)用500mL容量瓶配制400mL 1mol/L的丙溶液,需要丙的质量为________;配制过程中除用到容量瓶外,还需要的玻璃仪器有___________________。电解所配制的400mL溶液,当电路中通过1mol电子时,理论上可收集到的气体在标准状况下的体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)下列物质能导电的是 (填序号,下同),属于电解质的是 ,属于非电解质的是 。
①水银 ②CuSO4?5H2O ③大理石 ④氯化钠晶体 ⑤盐酸 ⑥氨气
⑦蔗糖 ⑧氯气 ⑨液态氯化氢 ⑩硫酸溶液
(2)按要求回答下列问题。
①Al2(SO4)3的电离方程式:
② NaHCO3的电离方程式:
③用化学方程式说明次氯酸钙粉末必须密封保存的原因:
④写出氯气与水反应的离子方程式:
(3)按要求完成下列填空:
①相同质量的氢气、甲烷、水,其中含分子数最多的是 。
②4.9 g H2SO4共含有 个原子。
③a个X原子的总质量为b g,则X的相对原子质量可表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(7分)欲测定某生铁(主要成分是铁,还含有少量的碳)的组成,进行了如下实验:称取粉末状样品8.50克,加入某浓度的盐酸100 mL ,充分反应后,收集到标准状况下气体2.24 L ;然后,继续往样品中加入同浓度的盐酸100mL ,充分反应后又收集到标准状况下气体1.12 L 。
试求:(写出具体计算过程)
(1)所取盐酸的物质的量浓度。(2)该生铁样品中碳的质量分数(保留3位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com